La queratoconjuntivitis vernal (QCV) es una queratoconjuntivitis bilateral crónica típica de los niños. Por lo general, se manifiesta en la primera década de la vida, aunque algunos casos se describen también en adultos.
Su prevalencia muestra una variabilidad geográfica extrema (Tabla 1). La mayor incidencia se reporta en los países africanos, con una incidencia que disminuye en proporción directa a la distancia desde el ecuador.
La QCV se caracteriza por prurito, fotofobia, descarga mucosa blanca, lagrimeo, sensación de cuerpo extraño y dolor debido a la afectación corneal de las úlceras en escudo. Los signos patognomónicos de la QCV son los puntos Trantas (agregaciones de células epiteliales y eosinófilos), papilas gigantes de adoquines en los párpados tarsales superiores y úlceras de escudo. Otros signos descritos son la hiperemia conjuntival, el infiltrado gelatinoso en el limbo, la neovascularización de la córnea y el seudogerontoxon. Hay tres formas de QCV: tarsal, limbal y mixta. La forma tarsal se caracteriza por las papilas en la tapa tarsal superior, mientras que la forma limbal por infiltrados gelatinosos en el limbo (caracterizada por una infiltración de linfocitos, células plasmáticas, macrófagos, basófilos, muchos eosinófilos y células conjuntivales mucinosas), puntos Trantas (nódulos blancos compuestos de eosinófilos y restos epiteliales ubicados en el limbo) y, de manera eventual, con queratitis punteada y úlceras en escudo. En la forma mixta, tanto la conjuntiva corneal como la tarsal están involucradas.
Aunque la QCV suele resolverse después de la pubertad, puede provocar discapacidad visual grave si el tratamiento no es el adecuado. El paciente podría desarrollar pérdida visual progresiva (notificada en 5 a 30% de los casos), úlceras en escudo, cataratas y glaucoma, causados por el uso excesivo y prolongado de colirios con esteroides.
La terapia de la QCV se basa en diferentes tipos de medicamentos. La forma leve se trata con gotas antihistamínicas para los ojos, estabilizadores de las células cebadas, gotas inhibidoras de eosinófilos (por ejemplo, ketotifeno) y ciclos cortos de esteroides tópicos. Las formas moderadas y graves requieren, en cambio, un ciclo prolongado de esteroides para controlar los signos y síntomas de la enfermedad, y/o una terapia inmunomoduladora con ciclosporina o colirios de tacrolimus. En casos muy raros, también existe la necesidad de un tratamiento quirúrgico para el desbridamiento de úlceras, así como en caso del glaucoma avanzado y las cataratas.
La QCV se clasifica entre las alergias oculares y representa uno de los 6 subtipos de alergia ocular [junto con la conjuntivitis alérgica estacional (CAE), la conjuntivitis alérgica perenne (CAP), la queratoconjuntivitis atópica (QCA), la blefaroconjuntivitis de contacto (BCC) y la conjuntivitis papilar gigante (CPG)]. Sin embargo, las causas subyacentes de la QCV siguen sin estar claras. La patogénesis implica una combinación variable de vías genéticas y endocrinológicas, así como factores ambientales y mediados por el sistema inmunológico.
En este estudio, se realizó una revisión sistemática de la literatura para proporcionar una descripción general completa de los métodos de diagnóstico disponibles para la QCV, su manejo y sus tratamientos.
Materiales y métodos
Se realizó una revisión sistemática de la literatura, de acuerdo con las recomendaciones de la guía Elementos de Reportes Preferidos para Revisiones Sistemáticas y Metaanálisis (PRISMA). Se realizaron búsquedas en la base de datos PubMed desde enero de 2016 hasta junio de 2023. No se restringió la investigación al idioma. Los términos de búsqueda: Vernal, Queratoconjuntivitis vernal y QCV.
En esta revisión, se incluyeron revisiones sistemáticas y narrativas, ensayos clínicos, estudios observacionales retrospectivos y prospectivos, series de casos y reportes de casos. De manera posterior, todos los estudios se dividieron en dos categorías: los que analizaban el diagnóstico de QCV y los que analizaban la terapia de la QCV. También se incluyeron en esta revisión estudios que describen las manifestaciones y el tratamiento de la QCV en pacientes adultos.
Elegibilidad del estudio y evaluación de la calidad
Se incluyeron en esta revisión todos los artículos que proporcionan datos diagnósticos o terapéuticos sobre QCV. Al principio, se revisaron títulos y resúmenes para descubrir estudios elegibles y luego se analizaron todos los textos completos para la evaluación final.
Los criterios de inclusión que se utilizaron para determinar si un artículo era apropiado fueron poblaciones de QCV (tanto niños como adultos), diagnóstico de QCV realizado con criterios de diagnóstico específicos y reporte de datos epidemiológicos, clínicos, diagnósticos y/o terapéuticos.
Se aplicaron los siguientes criterios de exclusión: el tema no relevante (población no apropiada o resultado no apropiado), estudios no originales (por ejemplo, artículos o comentarios duplicados) y estudios in vitro.
La calidad de los estudios elegibles se evaluó al utilizar diferentes métodos según el diseño del estudio: la Lista de Verificación Amstar 2 para Revisiones Sistemáticas, escala SANRA para Revisiones Narrativas, puntuación Jadad para Ensayos Clínicos Aleatorizados (ECA), Lista de Verificación Estroboscópica para Estudios Observacionales, Lista de Verificación de Evaluación Crítica del Instituto Joanna Briggs (JBI) para Reportes de Casos y Lista de Verificación de Evaluación Crítica del Instituto Joanna Briggs (JBI) para Series de Casos.
De cada estudio, se consideró información sobre el diseño del estudio, fecha de publicación, país de origen, ámbito, características de la muestra de población, objetivo del estudio y medida de resultado.
Resultados
El proceso de selección se muestra en la Fig. 1.
Al inicio se identificaron 211 artículos. Se excluyeron veinte estudios desde el título, 11 estudios se excluyeron después de leer los resúmenes y 15 estudios se excluyeron después de los análisis del texto completo. Se excluyeron diecinueve estudios por una población inapropiada (sólo pacientes con QCA, CAE o CAP), 16 estudios por un resultado inapropiado, 6 estudios por ser sólo in vitro, 3 estudios por proporcionar datos no útiles (estudios aún en progreso o protocolos de estudio futuros aún no implementados) y 2 estudios para proporcionar datos superpuestos al utilizar la misma población de estudio que un estudio incluido de forma previa.
Después del proceso de selección, 168 estudios fueron elegibles según los criterios y se incluyeron en la revisión.
Entre los 168 estudios considerados, 65 se referían al diagnóstico de QCV, 88 estudios describían terapias para QCV y 15 estudios discutían tanto el diagnóstico como la terapia. El diagrama de flujo de los estudios finales considerados para el diagnóstico y tratamiento se representa en las Figs. 2 y 3. Dos de los estudios incluidos en el tratamiento se consideraron tanto como revisión narrativa como serie de casos. Se incluyeron tres artículos después de una investigación manual.
Las características de los estudios incluidos se presentan en las Tablas 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 y 14.
Evaluación de calidad
Todos los estudios considerados en la siguiente revisión se analizaron para evaluar su importancia clínica según escalas apropiadas. La calidad de los estudios elegibles se evaluó al utilizar diferentes métodos según el diseño del estudio: Lista de Verificación Amstar 2 para Revisiones Sistemáticas, escala SANRA para Revisiones Narrativas, puntuación Jadad para Ensayos Clínicos Aleatorizados (ECA), Lista de Verificación Estroboscópica para Estudios Observacionales, Lista de Verificación de Evaluación Crítica del Instituto Joanna Briggs (JBI) para Reportes de Casos y Lista de Verificación de Evaluación Crítica del Instituto Joanna Briggs (JBI) para Series de Casos. De cada estudio, se consideró información sobre el diseño del estudio, fecha de publicación, país de origen, ámbito, características de la muestra de población, objetivo del estudio y medida de resultado.
Ninguna de las revisiones sistemáticas cumple con todas las características requeridas. El metaanálisis se realizó sólo en el estudio de Rasmussen et al y Roumeau et al. Con respecto a la revisión terapéutica de Leonardi et al, este estudio realizó una excelente investigación sistemática en la literatura al utilizar múltiples bases de datos y seleccionó todos los artículos con dos revisores separados. Sin embargo, los estudios incluidos no se describieron en detalle y no se presentó una lista completa de los estudios excluidos. Los autores no utilizaron una técnica satisfactoria para evaluar el riesgo de sesgo. En cuanto a la revisión terapéutica de Leonardi et al, también este estudio realizó una excelente investigación sistemática en la literatura, aunque no hubo una selección y extracción de estudios por duplicado. También faltó evaluar el riesgo de sesgo y proporcionar una lista de los estudios excluidos. La revisión sistemática de Singhal et al realizó una buena investigación sistemática en la literatura, pero la investigación no se realizó por revisores separados. Al igual que Leonardi et al, esta revisión no proporcionó una lista completa de los estudios excluidos y no utilizó una técnica para evaluar el riesgo de sesgo. Sin embargo, todos los estudios incluidos se describieron al indicar poblaciones, intervenciones, comparadores, resultados y diseños de investigación.
Roumeau et al y Rasmussen et al realizaron un metaanálisis detallado de la literatura. Un autor realizó todas las búsquedas bibliográficas y cotejó los resúmenes. Dos autores revisaron por separado los resúmenes y, según los criterios de selección, decidieron si los artículos eran adecuados para su inclusión. El riesgo de sesgo se describe de forma detallada. Las dos revisiones sistemáticas de Rasmussen et al realizaron un excelente metaanálisis de la literatura y describieron en detalle el riesgo de sesgo. Sin embargo, tanto Roumeau et al y Rasmussen et al no proporcionaron una lista de los estudios excluidos.
Las revisiones narrativas se evaluaron mediante la escala SANRA. Ninguno de los estudios cumple todos los criterios. Sólo alrededor de la mitad de los estudios proporcionaron información sobre cómo se realizó la búsqueda bibliográfica. El objetivo del estudio no se expresó de forma clara en seis de las revisiones narrativas. Se encontró que cuatro estudios carecían de descripción de datos. El mejor rendimiento lo obtuvieron Dahlmann-Noor et al y Doan et al, seguidos de Mehta et al y Ghauri et al (12/10). A excepción de Singh et al, todos realizaron una excelente investigación bibliográfica, al detallar los términos de búsqueda y los criterios de inclusión. En todos estos trabajos, las declaraciones clave se respaldaron por referencias adecuadas. Stock y colaboradores realizaron la mejor presentación de datos. Por otro lado, el peor desempeño lo tuvieron Takamura et al y Kraus (1/12 y 2/12, de manera respectiva). Ambos artículos carecen de una justificación de la importancia del artículo, no se expresaron objetivos o preguntas concretas, no se presentó la estrategia de búsqueda y los datos se presentaron de manera inadecuada. En el trabajo de Kraus, la evidencia apropiada se introdujo de forma selectiva, mientras que en Takamura et al el punto del artículo no se basó en argumentos apropiados.
Los ensayos clínicos aleatorios se evaluaron mediante la escala de Jadad. Todos ellos obtuvieron un mínimo de 3/5 puntos.
Leonardi et al, Bremond-Gignac et al y Gayger Müller et al cumplieron con todos los criterios de la lista de verificación. En el ensayo realizado por Zanjani et al, el modelo de aleatorización no se describió en detalle. El estudio de Chen et al no mencionó cómo se realizó el cegamiento.
Los estudios observacionales se analizaron con la Lista de Verificación Estroboscópica. El único estudio que alcanzó la puntuación máxima fue el de Zg et al. Todos los estudios de diagnóstico retrospectivos y observacionales incluyeron en sus trabajos un resumen apropiado, una introducción a la literatura subterránea, la justificación y el diseño de sus estudios. Sin embargo, en cinco casos no se describió de forma detallada el contexto del estudio y en tres casos no se reportaron todas las fechas relevantes (reclutamiento, exposición, seguimiento), mientras que en dos casos no se citó el ámbito y el hospital en el que se realizó el estudio. Todos los estudios describieron los criterios de inclusión y cómo se incluyó a los pacientes, sólo seis de ellos describieron cómo llegaron al tamaño final de la muestra. Sólo un estudio describió cómo los autores manejaron los factores de confusión y el riesgo de sesgo (Horinaka et al). Sólo siete estudios describieron cómo manejaron las variables cuantitativas en el análisis. Un estudio (Gupta et al) no incluyó en sus métodos una descripción precisa del análisis estadístico. En la sección de discusión, todos los estudios describieron sus resultados, una interpretación de estos basada en la literatura disponible y una generalización de los resultados que lograron. Sin embargo, dieciocho estudios no reportaron los límites de sus trabajos. Además, todos los estudios de terapia retrospectivos y observacionales incluidos en la investigación tenían un resumen adecuado (excepto González-Medina et al), una introducción con la justificación de sus trabajos, y una descripción de cómo se manejó el estudio. Seis artículos no reportaron todas las fechas relevantes, y en un caso, no se describió el ámbito. Un estudio (González-Medina et al) no informó los criterios de inclusión para el reclutamiento de los pacientes. La mayoría de los estudios no explicaron cómo llegaron al tamaño final de la muestra. Sólo tres autores consideraron el riesgo de sesgo en su análisis (Liendo et al, Müller et al, y Feizi et al). En diez casos, los métodos estadísticos utilizados en sus trabajos no se describieron en detalle. En cinco estudios, hubo una falta en la descripción demográfica de los pacientes incluidos. Un estudio (González-Medina et al) no discutió los resultados obtenidos. Quince estudios no reportaron los límites de sus trabajos. En un estudio (Samyukta et al), no se reportaron las fuentes de financiación.
Los reportes de casos y las series de casos se analizaron por medio de la Lista de Verificación de Evaluación Crítica del Instituto Joanna Briggs (JBI).
Ninguno de los reportes de casos cumplió de forma completa los criterios de la lista de verificación. De hecho, en todos los artículos, se encontró información faltante sobre el paciente (en particular, la etnia y la historia anamnésica). En seis artículos, no se informó si el paciente desarrolló algún efecto adverso de los medicamentos utilizados. En cuatro obras, faltaba información sobre cómo se evaluaron los signos de QCV.
Del mismo modo, ninguna de las series de casos analizadas cumplió los criterios de la lista de verificación, se obtuvieron 9 de cada 10 en la lista de verificación de evaluación crítica del JBI para la serie de casos. Dos estudios (Maharana et al, Patil et al) describieron los criterios de inclusión en detalle. Sólo un estudio (Maharana et al) realizó una inclusión consecutiva de los participantes, aunque no todos los pacientes consecutivos se incluyeron en el estudio, y se realizó un análisis estadístico de los resultados que surgieron.
En todas las series de casos, excepto Stock et al, se encontró información faltante sobre los pacientes (en particular la raza). En dos casos, los signos y síntomas de QCV no se midieron de manera estándar y confiable (Heffler et al, Callet et al). En un caso (Heffler et al), no se describió cómo se realizó el diagnóstico de QCV y faltaba información sobre los pacientes inscritos.
Manifestaciones clínicas de QCV
Los niños afectados por QCV acuden al oftalmólogo y al pediatra por quejarse de prurito intenso e hiperemia conjuntival. Suelen mostrar fotofobia intensa, secreción mucosa blanca (en especial por la mañana) y sensación de cuerpo extraño. En los casos más graves, también hay sensación de ardor o dolor ocular, lo que sugiere afectación corneal.
Ninguno de los síntomas que refieren los pacientes (prurito, fotofobia, sensación de cuerpo extraño) es patognomónico de la QCV, pero en otras alergias oculares, como la conjuntivitis alérgica estacional o la conjuntivitis alérgica perenne, estos síntomas suelen ser más leves que en la QCV.
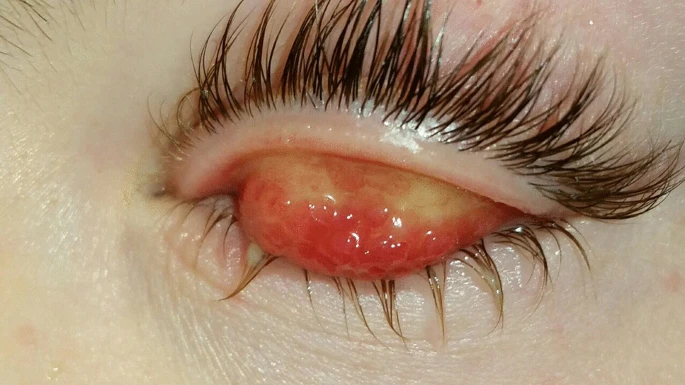
Los pacientes con QCV suelen presentar hiperemia conjuntival (Tabla 15, Fig. 4), papilas en el párpado tarsal superior (Fig. 5), inflamación limbal y puntos de Trantas (Fig. 4 y 6). Otros hallazgos son la neovascularización corneal y la formación del llamado “seudogerontoxon”. Si no se trata de forma adecuada, la enfermedad podría evolucionar hacia daño corneal, como queratitis puntiforme superficial y úlceras en escudo, un signo patognomónico de la QCV.
Una posible complicación temida de la QCV, en los países en desarrollo, es el glaucoma inducido por esteroides. La terapia a largo plazo con colirios con esteroides o fármacos esteroides sistémicos puede provocar, en especial en pacientes que responden a los esteroides, un aumento progresivo de la presión intraocular (PIO) y glaucoma. Un estudio indio realizado por Senthil et al describió una prevalencia de glaucoma inducido por esteroides en pacientes con QCV de 2.24 %. En estos sujetos, la PIO se controló de forma médica en 66 % de los casos, mientras que 34 % requirió tratamiento quirúrgico. Gupta et al observaron que entre los 1259 pacientes seguidos en su clínica por glaucoma activo, a 4% le recetaron esteroides tópicos para la QCV. En estos sujetos, la PIO se controló de forma médica en 55 % de los casos, y 45 % requirió cirugía filtrante.
Otra complicación dramática es el desarrollo de queratocono. Ahmed y colaboradores reportaron queratocono en 34 % de los casos de QCV. Según Kavitha et al, todos los niños afectados por QCV deberían examinarse para detectar queratocono, ya que tienen una elevación corneal posterior mayor que los controles. Además, Yılmaz et al encontraron una mayor incidencia de astigmatismo corneal posterior en casos de QCV en comparación con controles de la misma edad y sexo.
Diagnóstico de QCV
Evaluación oftalmológica
En el examen con lámpara de hendidura, los hallazgos típicos de QCV son hiperemia conjuntival, papilas en los párpados tarsales superiores e infiltración gelatinosa del limbo y los puntos de Trantas. Las papilas son variables en dimensiones: de hecho, pueden variar desde unos pocos milímetros hasta papilas gigantes (>7-8 mm), y dan a la conjuntiva tarsal un aspecto de “adoquines”. En casos más graves, si la córnea se involucra en el proceso inflamatorio, el examen con tinción con fluoresceína también podría resaltar queratitis puntiforme superficial y úlceras en escudo.
Para evaluar el daño corneal se propusieron en el último año diversas escalas, como el sistema de clasificación de Oxford y la escala de Oxford modificada, utilizada en pacientes con ojo seco. La última escala se propuso por Leonardi et al en 2020 y se denominó “puntuación de tinción corneal ajustada a las sanciones”. En esta escala, Leonardi et al propusieron utilizar el cambio en la tinción corneal con fluoresceína (CFS) desde el inicio en la escala de Oxford modificada, con posibilidad de penalizaciones en caso de terapia de rescate o úlcera corneal. En pacientes cuyo daño corneal estaba, según la escala de Oxford, en su nivel máximo (grado 5), no se pudo reportar ningún empeoramiento del daño corneal. Para captar ese agravamiento adicional durante el seguimiento, Leonardi et al propusieron agregar una penalización al puntaje, de la siguiente manera: + 1 punto de penalización por medicación de rescate y + 1 punto de penalización por ulceración corneal. La “puntuación de tinción corneal ajustada a la penalización” parecía ser un método confiable para evaluar los cambios corneales a lo largo del tiempo y para evaluar la eficacia de nuevos fármacos.
Otros hallazgos de la QCV son también la neovascularización corneal y el llamado “seudogerontoxon”, característico depósito de lípidos en el limbo.
Según el hallazgo clínico en el examen oftalmológico, la QCV se puede clasificar en tres formas:
– QCV tarsal: caracterizada por la presencia de papilas en el párpado tarsal superior
– QCV limbal: caracterizada por la presencia de infiltrado gelatinoso en el limbo y puntos de Trantas
– QCV mixta: caracterizada tanto por la presencia de papilas como por afectación limbal
De manera reciente, Soleimani et al observaron en pacientes mayores con QCV un hallazgo clínico particular: el “fenómeno Splendore-Hoeppli”. Este fenómeno consiste en una inflamación granulomatosa de la córnea con depósito de material eosinofílico en la conjuntiva. Se manifiesta como múltiples masas subconjuntivales lobuladas de color amarillo con vasos tortuosos, ubicadas en la porción superior de la conjuntiva bulbar, al lado del párpado superior. Según el autor, el fenómeno Splendore-Hoeppli parece ser una manifestación tardía de la QCV, que se presenta en pacientes afectados por queratoconjuntivitis primaveral desde hace algunas décadas.
Thong observó en sus poblaciones asiáticas de QCV también la presencia de seudomembrana en los párpados superiores y en los pliegues del párpado inferior, las llamadas líneas de Dennie. La línea Dennie-Morgan es un pliegue en la piel debajo del párpado inferior. En algunos casos, puede ser un rasgo genético, pero varios estudios lo relacionan con la sensibilización alérgica.
Gokhale en su revisión observó cómo la gravedad de la QCV podría definirse como leve, moderada-intermitente, moderada-crónica, grave y cegadora según los síntomas y los hallazgos clínicos. Los pacientes con enfermedad leve se quejan de prurito e hiperemia conjuntival. A la exploración presentan papilas finas y aterciopeladas en el párpado tarsal superior, pero sin afectación corneal. La observación clínica de pacientes con QCV moderada revela la presencia de queratitis puntiforme superficial, infiltrado gelatinoso del limbo (<50 % del limbo) y puntos de Trantas.
En la enfermedad grave, también hay evidencia de papilas gigantes activas, queratitis, macroerosiones de la córnea e infiltrado limbal grave (>50 % del limbo). Los pacientes con QCV cegadora muestran adoquines grandes activos, úlceras en escudo activas, inflamación anular del limbo grave, deficiencia de células madre del limbo y cicatrices.
Biomarcadores
En la última década, muchos estudios intentaron determinar si algunos biomarcadores podrían ayudar al diagnóstico de QCV, si los hallazgos clínicos no estaban claros (Tablas 16 y 17).
Los niveles de IgE y eosinófilos en lágrimas se elevaron en pacientes con QCV en comparación con controles sanos, pero también se encontraron niveles altos en queratoconjuntivitis atópica (QCA) conjuntivitis estacional (CAE) y perenne (CAP).
Un marcador que pareció ser más específico para el diagnóstico de QCV fueron los niveles de histamina en lágrimas. Los pacientes con QCV revelaron el doble de niveles de histamina en las lágrimas en comparación con los de los controles sanos. Sin embargo, los niveles de histamina en lágrimas también pueden aumentar en otras afecciones oculares, como la conjuntivitis por Haemophilus influenzae.
En otros estudios, se encontró que los niveles en lágrimas de eotaxina-1 y eotaxina-2 aumentaban en pacientes con QCV, pero también en sujetos con QCA. Además, los niveles parecieron correlacionarse con la gravedad de la enfermedad y la afectación corneal.
En 2020, Shoji demostró que los niveles lagrimales de CCL17/TARC, CCL24/eotaxina-2 e IL-16 en pacientes con QCV y QCA eran más altos que en pacientes con otras conjuntivitis alérgicas, como CAE y CAP (p < 0.01). Así, la evaluación simultánea de estos marcadores podría ayudar a realizar el diagnóstico diferencial entre QCA/QCV y CAE/CAP. La determinación de eotaxina-1 y eotaxina-2 tuvo una sensibilidad alta en el diagnóstico de QCV, pero una especificidad baja.
La proteína catiónica de los eosinófilos (PCE), un marcador de activación de eosinófilos aumentó en las lágrimas de pacientes con QCV y QCA y se correlacionó con la gravedad de la enfermedad. Shoji en su revisión reciente describió cómo en pacientes con QCV los niveles de PCE y eotaxina-2 se correlacionaban con la gravedad de la enfermedad (p < 0.01).
Otro estudio observó cómo los niveles de alfa-1-antitripsina en las lágrimas eran más bajos en QCV que en el grupo de control sano. Otros posibles biomarcadores de QCV podrían ser las concentraciones de osteopontina y periostina en las lágrimas. En 2016, Fujishima et al recogieron lágrimas de pacientes con enfermedad alérgica ocular para determinar el nivel de periostina en las diferentes formas de conjuntivitis alérgica. Su trabajo encontró niveles más altos de periostina en un sujeto afectado por alergias oculares que en pacientes alérgicos sin conjuntivitis (p < 0.05), con niveles máximos en QCA y QCV (p < 0.001).
Sin embargo, se necesitan más estudios para evaluar si las dosis de alfa-1-antitripsina, osteopontina y periostina pueden ser útiles en el diagnóstico de QCV.
Nebbioso et al evaluaron la concentración del factor de crecimiento endotelial vascular (VEGF) en muestras de sangre y lágrimas de pacientes con QCV. En su estudio, encontraron que los pacientes con QCV tenían niveles más altos de VEGF en lágrimas que los controles sanos (p < 0.05); sin embargo, esa diferencia no se confirmó en sangre (p = 0.29).
Otro estudio de Nebbioso et al evaluó la característica de la película lagrimal en pacientes con QCV mediante el método de prueba de helecho lagrimal (TFT). Observaron en esos sujetos una alteración patológica de la mucosa lagrimal (p < 0.001) que volvía a su estado inicial tras un periodo de tratamiento con colirio de ciclosporina. Ese trabajo subrayó la posible utilidad de la prueba de helecho lagrimal en la evaluación objetiva de la película lagrimal y como marcador de la actividad de la enfermedad y la eficacia terapéutica en pacientes con QCV. De hecho, algunos factores pueden cambiar la TFT, que no se comprenden por completo.
Inada et al utilizaron citología de impresión para determinar los niveles de receptores H1 y H4 (RH1 y RH4) en la superficie ocular de pacientes con QCV y QCA. Los niveles de RH1 y RH4 eran mayores en pacientes en una etapa activa de la enfermedad que en el grupo estable (p < 0.05), sin diferencias significativas entre los grupos QCA y QCV. La determinación de RH1 y RH4 se correlacionó con la gravedad de la enfermedad. Sin embargo, no permitió realizar un diagnóstico diferencial entre QCA y QCV.
Al utilizar citología de impresión, Leonardi et al observaron que en la conjuntiva de la QCV había una sobreexpresión de varias quimiocinas (CCL24, CCL18, CCL22, CXCL1), citocinas proinflamatorias (IL-1β, IL-6, IL-8, TGFβ-1) y genes relacionados con familias de transmisión de señales Th2 y Th17. Los receptores tipo Toll TLR4 y TLR8, Dectin-1/CLEC7A, mincle/CLEC4E, MCR1, NOD2 y NLRP3 y varios de sus genes relacionados con sus vías se sobreexpresaron en la QCV. Según el autor, el aumento de la expresión de varios factores quimiotácticos y señales coestimuladoras necesarias para la activación de las células T confirma que la QCV está mediada por células con eosinofilia local. Además, la expresión múltiple de receptores de reconocimiento de patrones (PRR) sugiere un papel de la interacción huésped-patógeno en el desarrollo de la QCV.
Costa Andrade et al utilizaron citología de impresión conjuntival para evaluar la expresión de galectina-3 (Gal-3) en pacientes con QCV y controles sanos. La Gal-3 es una proteína de unión a β-galactósido implicada en la patogénesis de la alergia ocular, al regular la migración de eosinófilos, la activación de las células cebadas y la producción de citocinas/quimiocinas locales. El estudio mostró un aumento significativo en la expresión de Gal-3 en el epitelio de pacientes con QCV (p < 0.001). Además, la expresión de Gal-3 se redujo en pacientes con QCV tratados con colirios con esteroides o colirios con tacrolimus (p < 0.001). Según los autores, Gal-3 podría servir como biomarcador de QCV y como diana terapéutica relevante para controlar la enfermedad.
Citología ocular
En el párrafo anterior se describieron algunos resultados obtenidos con la citología de impresión para el estudio de marcadores en QCV. Otra forma de realizar la citología ocular es mediante la cuantificación de células y marcadores en lágrima mediante cepillado o biopsia conjuntivales. La citología ocular, descrita por primera vez en 1977 por Egbert et al, se aplica en el estudio de un número discreto de enfermedades oculares, como ojo seco, conjuntivitis alérgica y enfermedades inflamatorias sistémicas con uveítis (Tabla 18).
Por ejemplo, el hallazgo de al menos un eosinófilo o célula cebada (siempre ausente en la conjuntiva de sujetos sanos) es un marcador óptimo de enfermedad conjuntival alérgica.
Un estudio reciente de Bruschi et al realizado con cepillado conjuntival mostró que la conjuntiva no tratada de pacientes con QCV se caracterizaba por un número elevado de eosinófilos, neutrófilos, células cebadas y células epiteliales. Estos recuentos de células se redujeron de forma progresiva si los sujetos se trataban con gotas para los ojos con esteroides o inmunosupresores.
Nebbioso et al el uso de citología de impresión demostró que los pacientes con QCV tenían un número mayor de células caliciformes en la conjuntiva en comparación con los controles sanos, aunque esa diferencia no fue significativa de forma estadística. Después de un ciclo de terapia con colirios de ciclosporina, la densidad de las células caliciformes se redujo de forma progresiva (p = 0.044).
Biopsia conjuntival
En biopsias conjuntivales de pacientes con QCV, se describe un número elevado de células cebadas, linfocitos B y T, eosinófilos y fibroblastos (Tabla 19).
Leonardi et al utilizaron muestras de biopsia conjuntival para evaluar los niveles de chaperonas de proteínas de choque térmico (Hsp) en la conjuntiva de pacientes con QCV. Estas proteínas participan en la comunicación intercelular tanto en condiciones fisiológicas como patológicas. Este estudio demostró que algunos subtipos de Hsp (Hsp27, Hsp40, Hsp70 y Hsp90) eran más altos en la conjuntiva de pacientes que en los controles sanos. Según los autores, la comprensión del papel de las chaperonas en la conjuntiva en la QCV podría abrir nuevos escenarios terapéuticos que conduzcan, por ejemplo, al uso de inductores o inhibidores tópicos específicos de las Hsps para prevenir complicaciones oculares graves. Sin embargo, dada la invasividad del muestreo, las biopsias conjuntivales se utilizan de forma excepcional en el diagnóstico de la QCV.
Niveles de vitamina D en Pacientes con QCV
En los últimos años aumentó el interés en la evaluación de los niveles de vitamina D en Pacientes con QCV.
La vitamina D es una sustancia prohormonal que regula una gama amplia de funciones en el cuerpo humano, incluido el nivel mineral de los huesos y la respuesta del sistema inmunológico. La principal fuente de vitamina D es la exposición al sol. Su deficiencia puede provocar raquitismo, mayor riesgo de infecciones de las vías respiratorias y enfermedades autoinmunes. Los niveles séricos de 25-hidroxivitamina D (25OHD) inferiores a 20 ng/mL, reportados en hasta 50 % de los niños, indican una deficiencia, mientras que los niveles séricos <30 mg/dL, reportados en 80 % de los pacientes pediátricos, indican una concentración insuficiente de vitamina D en sangre. Los niños afectados por QCV, debido a su notable fotofobia y al empeoramiento de sus síntomas en verano con la exposición solar, tienden a evitar la luz solar y las actividades al aire libre durante la primavera y el verano, y así poder aumentar el riesgo de sufrir deficiencia de vitamina D.
Ghiglioni et al observaron que en primavera, 81 % de los niños con QCV tenían niveles séricos insuficientes de 25OHD (<30 ng/ml) y 33 % tenía una deficiencia manifiesta (25OHD <20 ng/ml). Si el sujeto se trató con ciclosporina o colirio de tacrolimus durante el verano, con una mejoría en los signos y síntomas de QCV y el consiguiente aumento en la exposición a la luz solar, hubo un aumento en los niveles séricos de vitamina D. De hecho, al final del verano, 39 % de los niños todavía tenía niveles insuficientes de vitamina D, pero sólo 4 % tenía 25OHD <20 ng/ml.
Zicari et al y Sorkhabi et al observaron que los niños afectados por QCV tenían niveles más bajos de vitamina D en comparación con los controles sanos. Según Zicari et al, después de 6 meses de tratamiento con ciclosporina, estos niveles aumentaron (p = 0.004) pero eran más bajos que en los controles sanos (p < 0.05).
Los niveles de vitamina D parecen ser un marcador del control de la enfermedad en pacientes con QCV. Un sujeto tratado podría recibir niveles de exposición al sol similares a otros niños, lo que permitiría una mejora en los niveles séricos de vitamina D. En cambio, si la enfermedad es grave y no se trata de forma adecuada, los niveles de vitamina D permanecen bajos.
Terapia
La base de la terapia QCV son reglas de comportamiento. Entre ellas, las más útiles son:
– Evitar el contacto con aeroalérgenos, como flores y plantas
– Evitar la exposición prolongada a la luz solar
– Usar gafas solares
– Aplicar envolturas frías en los ojos
– Usar lágrimas artificiales que podrían eliminar o casi diluir los alérgenos presentes en la superficie ocular
– Lavarse la cara, las manos y el cabello con frecuencia, en especial antes de ir a dormir
Sin embargo, las reglas de comportamiento y las lágrimas artificiales por sí solas no pueden controlar los síntomas de la QCV, excepto en sus formas más leves.
Los fármacos que demostraron su eficacia en el tratamiento de la QCV son los antihistamínicos tópicos, colirios antiinflamatorios, colirios con esteroides, colirios de ciclosporina, tacrolimus y, de manera reciente, omalizumab.
Antihistamínicos y antiinflamatorios no esteroideos tópicos
Entre los antihistamínicos y colirios antiinflamatorios, las moléculas más utilizadas se muestran en la Tabla 20.
Todos estos fármacos demostraron su eficacia en la forma más leve de QCV. Sin embargo, sólo en unos pocos casos son capaces de controlar la enfermedad por sí solos. La terapia antihistamínica y antiinflamatoria podría ayudar en el tratamiento de la QCV, pero con frecuencia se requiere terapia concomitante con colirios con esteroides o moléculas inmunomoduladoras.
Las gotas oftálmicas de ketorolaco y diclofenaco, que interfieren con la síntesis de prostaglandinas E2 e I2, reducen el prurito y la hiperemia conjuntival, pero no tienen ningún efecto sobre las dimensiones de las papilas ni sobre la reparación de las lesiones corneales.
Terapia con esteroides
Los esteroides son eficaces para controlar la inflamación mediante varios mecanismos:
– Reducir el número y la actividad de los leucocitos
– Bloquear la producción de IL-2 y la consiguiente expansión clonal de los linfocitos T auxiliares
– Bloquear la proliferación de fibroblastos
– Interferir con la actividad de la ciclooxigenasa 2 (COX2) y bloquear la síntesis de prostanoides
– Interferir con la síntesis de histamina, IgG y otros factores flogísticos
Las gotas oftálmicas con esteroides son el tratamiento estándar de oro para la QCV, pero, debido a sus graves efectos adversos (aumento de la PIO, infecciones corneales, cataratas y glaucoma), el objetivo es controlar la enfermedad al utilizar la dosis más baja posible de esteroides. En el tratamiento de la QCV, el esteroide se puede administrar de tres formas diferentes: gotas para los ojos (la forma de administración más común), inyección tópica en la conjuntiva y medicamentos orales (mayor eficacia, pero mayores efectos adversos).
Gotas para ojos con esteroides
La administración de gotas oftálmicas con esteroides es una de las terapias más útiles para la QCV. Siempre son efectivos. Si un paciente no muestra una respuesta clínica en unos pocos días, podría estar afectado por una infección bacteriana o viral ocular que complica la QCV y debe remitirse de inmediato a un oftalmólogo.
El fármaco esteroide más nuevo, loteprednol, parece ser más seguro que los fármacos de la generación anterior.
Jongvanitpak et al observaron en su estudio observacional retrospectivo en niños tailandeses que 68.8 % de los pacientes con QCV utilizan esteroides tópicos para controlar la enfermedad.
En la práctica diaria, los esteroides locales se utilizan con esquemas terapéuticos diferentes, que van desde un esquema de disminución gradual durante 2 a 3 semanas, hasta ciclos cortos y repetibles de 3 a 5 días, hasta administraciones diarias prolongadas en dosis bajas después de 1 a 3 semanas, ciclo de reducción gradual. La opción más adecuada parece ser el esquema de 3 a 5 días.
Inyección tarsal de esteroides
En una forma grave de QCV, el médico podría considerar la inyección supratarsiana de corticoesteroides para controlar los signos y síntomas de la QCV. Se podrían utilizar succinato sódico de dexametasona, acetónido de triamcinolona y succinato sódico de hidrocortisona.
En 2017, Costa et al realizaron una inyección supratarsal de acetónido de triamcinolona en 17 niños con QCV grave, y observaron una rápida mejoría en los signos y síntomas de QCV sin ninguna reacción adversa.
De manera similar, McSwiney et al realizaron inyecciones supratarsianas de acetónido de triamcinolona en pacientes con QCV, con una mejoría de la agudeza visual (p < 0.0001) y de los síntomas de QCV en 100 % de los casos.
Terapia sistémica con esteroides
La administración oral de esteroides, aunque es muy eficaz para controlar la enfermedad, rara vez se implementa como tratamiento en la QCV, debido a la frecuencia alta y la gravedad de los efectos adversos reportados.
Debido a la larga duración de los síntomas de QCV durante el año (al menos 5 a 6 meses), el uso de terapia con esteroides solos no es factible como terapia crónica. Un tratamiento con esteroides de 6 meses puede provocar sobreinfección bacteriana, queratitis herpética, hipertensión ocular, glaucoma y cataratas, como se describe en 3.5 % de los niños tratados. A la luz de estos efectos adversos, en las últimas décadas se desarrollaron preparados oftálmicos a base de ciclosporina y, de manera más reciente, colirios de tacrolimus.
Gotas inmunomoduladoras para los ojos
La ciclosporina tiene numerosos efectos sobre el organismo:
– Bloquea la activación de los linfocitos T
– Detiene la producción de IL-2 y sus receptores
– Bloquea la liberación de histamina de los basófilos y las células cebadas
– Reduce la expresión del antígeno leucocitario humano II (HLA-II) en las células.
Además, la ciclosporina
– Interfiere con reacciones de hipersensibilidad y desgranulación de células cebadas
– Reduce los niveles de PCE y eosinófilos en las lágrimas
– Controla de forma rápida la flogosis local y actúa como agente ahorrador de esteroides
A diferencia de un corticoesteroide, la terapia con ciclosporina no causa cataratas ni glaucoma. Sus posibles efectos secundarios, al administrar por vía oral, se producen en hígado y riñones.
Sin embargo, varios estudios demostraron que la ciclosporina administrada en forma de colirio no se absorbe en la circulación y, en consecuencia, no provoca efectos secundarios sistémicos. La única reacción adversa descrita en la literatura es el ardor al instilar las gotas. Esto se debe a la formulación farmacéutica del compuesto, en la que también está presente el ácido etílico. Sin embargo, el ardor es siempre transitorio y dura sólo unos minutos.
Al ser un agente inmunosupresor, podría causar sobreinfecciones bacterianas o virales, reportadas de forma rara en la literatura. En las últimas tres décadas, la ciclosporina se probó en diversas formulaciones (diluida en aceite de ricino o lágrimas artificiales) y en diversas concentraciones (2 %, 1 %, 0.5 %, 0.25 %) (Tabla 21). Hasta el momento, aún no se conoce la dosis mínima eficaz para la terapia ocular con QCV.
En 2017, Thong revisó la administración de gotas oftálmicas de ciclosporina 0.05 %, 0.1 % y 1 % en una gran cohorte de niños con QCV y observó la eficacia de estas preparaciones para reducir los signos y síntomas de QCV. Yücel y sus colegas también probaron ciclosporina 0.05 % en 2016 en 20 niños y adolescentes con QCV, y así obtener los mismos resultados. No se reportaron efectos adversos.
Nebbioso et al centraron su atención en la solución oftálmica de ciclosporina 0.1 % (Papilock mini® y Verkazia®). Encontraron en la literatura una cohorte de 3198 pacientes en los que el tratamiento con ciclosporina 0.1 % colirio administrado 2 a 4 veces al día durante 4 a 6 meses fue eficaz para controlar las manifestaciones graves de QCV.
En 2019, Leonardi y sus colegas realizaron un ensayo clínico aleatorizado (“Estudio Vektis”) cuyo objetivo era evaluar la eficacia y seguridad del tratamiento con ciclosporina 0.1 % en emulsión catiónica en comparación con un placebo en la QCV grave. Los pacientes se asignaron al azar en tres grupos: un grupo recibió gotas para los ojos de ciclosporina 4 veces al día (grupo de dosis alta), otro grupo gotas para los ojos de ciclosporina 2 veces al día (grupo de dosis baja) y el tercer grupo un placebo. Los pacientes tratados con ciclosporina 4 veces/día o 2 veces/día mostraron una mayor mejoría en los signos y síntomas de QCV en comparación con el grupo placebo (p = 0.007 y 0.010) y tuvieron un menor uso de colirios con esteroides de rescate (p = 0.010 y 0.055, de manera respectiva). La mayoría de los eventos adversos que surgieron durante el tratamiento eran de gravedad leve o moderada y consistieron en ardor local durante la instilación. Este hallazgo se describió también por Bremond-Gignac et al, quienes confirmaron las conclusiones de Leonardi et al también en el seguimiento de 8 meses. Los efectos adversos más frecuentes: dolor a la instilación y prurito.
Westland et al en 2018 describieron un régimen intenso de ciclosporina 0.05 % para las úlceras en escudo primaverales. En su serie de casos, los tres niños tratados con ciclosporina ocho veces al día mostraron una rápida resolución de las úlceras en escudo y una reepitelización completa.
En 2020, Modugno et al observaron que un ciclo de terapia con ciclosporina actúa a nivel del epitelio, el plexo nervioso subbasal y el estroma, realiza cambios microestructurales corneales progresivos, y ayuda a restaurar la microestructura corneal normal (p < 0.001).
Borrego-Sanz et al describieron el caso de un niño de 10 años a quien se le administró ciclosporina por vía oral durante meses. En ese reporte, la terapia diaria con ciclosporina oral permitió la reepitelización de la úlcera en escudo vernal y permitió la disminución gradual de las gotas oftálmicas con esteroides.
Aunque es muy eficaz para controlar los signos y síntomas de la QCV, entre 8 y 15 % de los niños no muestran la mejoría esperada con el tratamiento. En estos pacientes, el colirio de tacrolimus puede ser una alternativa útil.
Tacrolimus es una terapia alternativa a la ciclosporina para controlar los signos y síntomas de la enfermedad (Tabla 22). Actúa sobre la inflamación ocular:
– Bloquea la producción de IL-2
– Detiene las secreción de IL-3 e IL-4
– Reduce la degranulación de las células cebadas
En 2017, Thong revisó el uso de la solución oftálmica de tacrolimus en la literatura en una gran cohorte de pacientes, al observar su eficacia en la reducción de los signos y síntomas de QCV a diversas concentraciones (0.005 %, 0.03 %, 0.1 %).
Erdinest y sus colegas encontraron en la literatura 1121 pacientes tratados con soluciones oftálmicas de tacrolimus (con una variable de concentración de 0.003 a 0.1 %): el mayor número de pacientes mostró una mejora clínica después del tratamiento.
En 2016, Al-Amri et al probaron una terapia de 0.1 % de tacrolimus de 6 semanas en 20 pacientes adultos con QCV, concluyeron que el tratamiento permitió una mejora significativa en los síntomas de QCV (p < 0.001) y signos (p < 0.001).
El mismo año, Barot y sus colegas también experimentaron con la administración de Tacrolimus 0.1% de ungüento en QCV. Ese estudio observó una mejora importante en el control de la enfermedad (p < 0.0001). Alrededor de 36 % de los pacientes se quejaron de una sensación de ardor transitoria durante el tratamiento.
En 2018, Wan et al observaron una mejora significativa en los signos y síntomas (p < 0.001) después de 1 semana de terapia con tacrolimus 0.1 %.
La concentración de tacrolimus 0.1% se analizó también en 2019 por Liu y sus colegas. Administraron tacrolimus a diez niños, y observaron una reducción importante en la reacción conjuntival y corneal (p = 0.0003 y 0.0002) y su consiguiente potencial como agente de soporte de esteroides. De hecho, en 6 de cada 10 pacientes, el tratamiento con tacrolimus permitió la interrupción de la terapia con esteroides (p < 0.05).
En 2017, Al-AMRI y su equipo administraron una terapia de 0.003 % de tacrolimus menos concentrada durante 6 semanas a 20 adolescentes afectados por una forma grave y resistente de QCV. En todos los pacientes, la terapia prescrita permitió una mejora significativa en los síntomas de QCV (p < 0.001) y signos (p < 0.001), sin efectos secundarios importantes.
En 2019, Samyukta et al intentaron un tratamiento de 8 meses con una solución oftálmica de tacrolimus más concentrada (0.3 %) en 30 niños con QCV, y observaron una disminución importante de los signos y síntomas de QCV (p < 0.001) y una mejoría de la agudeza visual (p = 0.04).
En 2019, Shoji et al quisieron evaluar si la eficacia de la solución oftálmica de tacrolimus era diferente en pacientes con dermatitis atópica concomitante o no. Para ello, inscribieron una cohorte de 1,821 adolescentes y adultos jóvenes afectados por la enfermedad conjuntival alérgica crónica (QCA o QCV) con y sin dermatitis atópica. La terapia con tacrolimus mostró su eficacia en la reducción de los signos y síntomas oculares en ambos grupos (p < 0.0001). El uso concomitante de esteroides tópicos aumentó la probabilidad de remisión (p < 0.0001).
Chatterjee y Agrawal probaron en 2016 una solución oftálmica de tacrolimus a 0.03 % con la administración de ese fármaco en 23 adolescentes con QCV. En su estudio, los síntomas y signos se redujeron a las 4 y 12 semanas (p < 0.0001). Además, la agudeza visual mostró una mejora después de 12 semanas de tratamiento (p = 0.05).
Los mismos resultados se observaron también en 2019, Fiorentini y Khurram administraron ungüento de tacrolimus a 0.03 % en 10 niños árabes con QCV. Después de un tratamiento de 4 semanas, todos los sujetos mostraron una mejora en su sintomatología sin ningún efecto adverso. Müller y sus colegas lograron resultados similares ese mismo año. De hecho, en sus pacientes con QCV, la pomada tópica de tacrolimus a 0.03 % logró el control de la enfermedad. Además, en 47.6 % de los pacientes se pudo interrumpir el tratamiento con esteroides.
González-Medina et al probaron a 17 adolescentes con ungüento para ojos de tacrolimus a 0.03 % QCV. La terapia permitió el cese del tratamiento antihistamínico en 8 pacientes (p < 0.05). No se redujo el número de exacerbaciones por año, pero sí la duración y la gravedad de cada exacerbación.
En la literatura se reportan varios estudios con una concentración mínima de tacrolimus, como 0.01 % probada por Shoughy et al en Arabia Saudita. En su estudio, 62 niños con QCV se trataron con solución oftálmica de tacrolimus 0.01 %, con una mejoría importante en los signos y síntomas de QCV (p < 0.001).
En 2017, Zanjani et al realizaron un ECA que tuvo como objetivo comparar la eficacia de tacrolimus a 0.005 % frente a colirios de interferón alfa-2b (IFN alfa-2b) en el tratamiento de la QCV. Tanto los pacientes tratados con tacrolimus como los pacientes tratados con IFN alfa2b mostraron una mejoría en los signos y síntomas de QCV después de 3 años (p < 0.0001 para ambos grupos), sin diferencia estadística significativa entre los dos grupos (p > 0.05). No se observaron complicaciones oculares importantes ni efectos secundarios sistémicos relacionados con tacrolimus e IFN alfa-2b.
Los autores concluyeron que tanto el tacrolimus 0.005 % como el IFN alfa-2b podrían ser tratamientos prometedores y eficaces para la QCV resistente.
El mismo año, Gayger Müller y sus colegas evaluaron la eficacia de tacrolimus versus monoterapia con cromoglicato de sodio en QCV. En su ECA, trataron a ocho pacientes con colirio de tacrolimus a 0.03 % y a ocho pacientes con cromoglicato de sodio. El tacrolimus fue más eficaz que el cromoglicato de sodio en el control de los signos y síntomas de la QCV (p = 0.001 y 0.015).
En 2021, Maharana et al realizaron una terapia local combinada con ciclosporina 0.1 % y tacrolimus 0.03 % en 11 pacientes con QCV, al observar que la combinación fue de gran ayuda para mejorar los signos y síntomas de la QCV (p < 0.001).
En 2022, Heikal et al demostraron que tacrolimus a 0.03 % permitió una reducción de los síntomas y signos individuales mejor que el colirio con ciclosporina 2 %.
En 2021, el estudio independiente de Caputo et al, Hirota et al y Yazu et al demostraron de forma retrospectiva cómo el uso a largo plazo de tacrolimus tópico es una opción segura para la QCV refractaria.
De hecho, al igual que la ciclosporina, el tacrolimus se tolera bien. El único efecto secundario reportado es ardor al instilar las gotas. Al ser un agente inmunosupresor, también podría aumentar el riesgo de infecciones oculares.
Si se administra por vía oral, es tóxico para los riñones y el sistema nervioso. También podría provocar hipertensión, diabetes, infecciones, tumores y trastornos gastrointestinales. Si se administra de forma tópica en el ojo, la absorción sistémica de tacrolimus es casi nula; por lo tanto, nunca se reportaron efectos adversos sistémicos en la literatura.
Anticuerpos monoclonales
El omalizumab es un anticuerpo monoclonal anti-IgE. Se creó para tratar el asma alérgica, pero, en los últimos años, su uso se extendió también al tratamiento de otras afecciones alérgicas, como dermatitis atópica, urticaria crónica, rinitis alérgica, aspergilosis broncopulmonar alérgica y alergia alimentaria. En los últimos años, el omalizumab se probó también en el tratamiento de la QCV recalcitrante, con buenos resultados (Tabla 23).
Los únicos efectos adversos reportados en la literatura son dolor en el lugar de inyección, cefalea, faringitis, síntomas del tracto respiratorio superior y sinusitis.
Doan et al realizaron una revisión de la literatura al evaluar la eficacia del tratamiento con omalizumab en la QCV refractaria grave. El omalizumab, que permite reducir los signos y síntomas, parece ser un tratamiento potente para las formas refractarias de QCV. La evidencia más sólida la proporcionaron Doan y sus colegas, quienes administraron omalizumab a cuatro niños de entre 7 y 13 años. Tres de los 4 pacientes respondieron al tratamiento, pero la respuesta fue incompleta.
Otros estudios que describen el uso de omalizumab en pacientes con QCV se realizaron por Heffler et al (2 pacientes, ambos mostraron una mejoría en los síntomas de QCV, el examen físico y los hallazgos citológicos conjuntivales), Occasi et al (4 niños de 6 a 11 años, todos respondieron al tratamiento con omalizumab sin efectos secundarios), Callet et al (2 niños de 7 a 9 años, todos tuvieron una mejora en QCV y control del asma), Santamaría y Sánchez (1 paciente de 15 años que tuvo mejoría de los síntomas de QCV una vez administrado omalizumab; sin embargo, al suspender el fármaco los síntomas recayeron), y Simpson y Lee (1 adulto con QCV , en el que una dosis única de omalizumab pareció resolver todos los signos y síntomas de QCV).
En la literatura, el omalizumab no es el único anticuerpo monoclonal utilizado en la QCV, aunque sí el más estudiado.
En 2022, Tsui et al administraron dupilumab, anticuerpo monoclonal humano contra el receptor alfa de interleucina (IL)-4, a tres niños afectados por QCV refractaria (de 7 a 14 años), obtuvieron un control total de los signos y síntomas de QCV dentro de 1 mes de tratamiento. El tratamiento con dupilumab también resultó en la resolución de la úlcera en escudo, reepitelización corneal y resolución completa de las papilas gigantes en la conjuntiva tarsal superior en todos los pacientes. Sin embargo, cabe recordar que en la literatura el tratamiento con dupilumab se asocia con el desarrollo de ojo seco y conjuntivitis como reacción adversa. La aparición de efectos secundarios en los pacientes tratados con dupilumab por dermatitis atópica, ya descritos en la literatura, permitió demostrar la eficacia del upadacitinib, un inhibidor de JAK2, en un caso de dermatitis atópica grave y QCA. Hasta donde se sabe, el upadacitinib aún no se aprueba en pacientes con QCV.
En 2022, Anesi et al probaron la administración de lirentelimab, anticuerpo monoclonal contra la lectina similar a la inmunoglobulina transportadora de ácido siálico (Siglec)-8, en un hombre de 25 años con QCV, asma y rinitis alérgica, y descubrieron que el lirentelimab era bien tolerado y mejoraba los síntomas alérgicos concomitantes de QCV, con reducción de mediadores inflamatorios en las lágrimas del paciente.
Otros anticuerpos monoclonales, como mepolizumab, reslizumab y benralizumab, están bajo investigación por su eficacia en el asma eosinofílica y también pueden ser útiles en otras enfermedades alérgicas y la QCV.
Se necesitan ensayos clínicos para investigar sus posibles beneficios terapéuticos en otros tipos de afecciones mediadas por eosinófilos, como la QCV.
Otros medicamentos
El año pasado, un gran estudio de cohorte realizado por Xu y Cai tuvo como objetivo evaluar los efectos terapéuticos y la seguridad de las gotas para los ojos de houttuynia (Houttuynia cordata) combinadas con clorhidrato de olopatadina en pacientes con QCV. Observaron que los niños tratados con la asociación de houttuynia y colirio de olopatadina mostraron una rápida reducción de los síntomas de QCV (p < 0.05), sin efectos adversos.
Tratamiento quirúrgico
El tratamiento quirúrgico utilizado en la QCV se resume en la Tabla 24.
Stock y colaboradores revisaron el desbridamiento quirúrgico de las úlceras del escudo de la QCV en la literatura. Encontraron sólo cuatro estudios en pacientes con QCV y en todos ellos el desbridamiento quirúrgico demostró ser eficaz en el tratamiento de las úlceras en escudo. El procedimiento se siguió de una rápida reepitelización corneal y no se describieron efectos adversos. Describieron también su experiencia con dos niños tratados con desbridamiento quirúrgico de la úlcera, en los que el tratamiento quirúrgico fue curativo y definitivo en el período de seguimiento de 7 meses.
En 2017, Abozaid intentó evaluar la seguridad y eficacia de la implantación de Keraring (anillo corneal) asistida por láser de femtosegundo seguida de reticulación corneal acelerada transepitelial (CXL) para el tratamiento del queratocono en niños con QCV. En su estudio observacional, todos los ojos tratados mostraron una mejoría en la agudeza visual, los valores de queratometría y la refracción (p < 0.001). No se reportaron complicaciones intraoperatorias.
Además, Alrobaian y colegas realizaron un estudio retrospectivo para determinar la seguridad y eficacia del entrecruzamiento del colágeno corneal (CXL) en pacientes con queratocono y QCV. Sin embargo, en los 19 pacientes tratados no se observó diferencia significativa entre los valores basales y del último seguimiento de agudeza visual (p = 0.99) y la queratometría (p = 0.093). Además, 5 de 27 ojos con QCV mostraron progresión del queratocono (18.5 %).
En 2019, Abozaid et al realizaron un estudio observacional retrospectivo de 28 adolescentes con QCV para evaluar la implantación del segmento de anillo corneal intraestromal (ICRS) asistida por láser de femtosegundo seguida o acompañada de entrecruzamiento acelerado transepitelial de colágeno corneal (TE-ACXL) como tratamiento del queratocono en la QCV. En ese estudio observaron mejor agudeza visual (p = 0.001) y medida corneal (p < 0.001) en los pacientes tratados con Keraring + CXL con respecto a los pacientes tratados con CXL solo.
En 2020, Iqbal et al realizaron un ensayo controlado para comparar el entrecruzamiento estándar sin epitelio (SCXL) versus el entrecruzamiento acelerado sin epitelio (ACXL) y el entrecruzamiento transepitelial con epitelio (TCXL) en el tratamiento del queratocono en niños. Ciento treinta y seis pacientes con queratocono (de los cuales 38 también tenían QCV) se asignaron al tratamiento quirúrgico SCXL, ACXL o TCXL. El autor observó diferencias significativas en la agudeza visual y la medida refractiva entre los tres grupos a lo largo del estudio (p < 0.0001) a favor de SCXL seguido de ACXL. El protocolo SCXL fue superior a ACXL y TCXL, con una tasa de éxito general de SCXL de 100 % durante 2 años de seguimiento.
En 2018, Iyer et al publicaron un estudio observacional retrospectivo destinado a evaluar los resultados del injerto de membrana mucosa (IMM) para papilas gigantes refractarias en la QCV. Seis niños los trataron con IMM. Después de la cirugía se observó reactivación de la actividad alérgica en todos los ojos, pero sin recurrencia de úlceras en escudo ni queratitis puntiforme difusa.
En 2019, Hopen et al reportaron un caso de reducción de la presión intraocular (PIO) después de una trabeculectomía transluminal asistida por gonioscopia (GATT) en un niño con QCV, en el que el único efecto adverso fue un pequeño hipema.
En 2016, Das et al describieron el caso de un varón de 22 años afectado por QCV al que se le realizó trasplante de membrana amniótica, seguido de cirugía de cataratas y prótesis ópticas para el tratamiento de las complicaciones de la QCV, con buenos resultados globales.
En 2022, Senthil et al compararon en un estudio observacional retrospectivo la tasa de éxito quirúrgico de la trabeculectomía, trabeculectomía con mitomicina C y trabeculectomía combinada con extracción de cataratas para el tratamiento del glaucoma, encontraron datos similares a los 5 años de seguimiento. Las tres técnicas quirúrgicas demostraron ser efectivas, pero el resultado quirúrgico es proporcional de forma inversa a la edad del niño, la duración de la QCV, la duración de la terapia con esteroides y el tipo mixto de uso de esteroides.
En la literatura, es una idea común que la QCV debe tratarse “paso a paso”. La mayoría de los autores (Fauquert et al, Takamura et al, Gokhale et al, Berger et al, CAEchetti et al, Esposito et al, AlHarkan et al, Maitra et al, Kraus) aceptaron reservarse colirios de ciclosporina, tacrolimus y medidas quirúrgicas en la forma más grave de QCV, mientras que las formas leves y moderadas deben tratarse con antihistamínicos y ciclos de colirios con esteroides. Además, la revisión sistemática de Singhal et al observaron que el tratamiento quirúrgico (como el desbridamiento de la úlcera corneal o la resección de papilas gigantes) debe realizarse sólo en casos de hipertrofia papilar gigante grave o úlcera en escudo refractaria, mientras que la mayoría de los pacientes con QCV pueden tratarse sólo con medicación.
Conclusiones
La QCV es una enfermedad de la cámara anterior del ojo con una etiología poco clara. El diagnóstico es clínico, ya que aún no se identificaron marcadores seguros de la enfermedad y su gravedad. Asimismo, no se establecieron marcadores que puedan utilizarse para el seguimiento.
Sería deseable elaborar una puntuación basada en parámetros estandarizados y compartidos de signos objetivos, síntomas subjetivos y posible presencia de complicaciones. La puntuación debe corregirse en función de la realidad geográfica y la estación en la que se detecta, para hacer comparables los datos recogidos y evaluar la eficacia de la terapia en diferentes latitudes.
En la literatura se describe la gradualidad de la terapia, pero sin parámetros objetivos claros en los que basar su modificación. En algunos casos, el riesgo es iniciar la terapia inmunomoduladora si las lesiones ya están demasiado avanzadas.
También debería estudiarse el uso de fármacos biotecnológicos, a falta de un estudio preciso de las citocinas inflamatorias presentes en el ojo y a falta de métodos para la determinación de estas citocinas a nivel lagrimal que puedan utilizarse en la rutina clínica.
Bruschi, G., Ghiglioni, D.G., Cozzi, L. et al. Vernal Keratoconjunctivitis: A Systematic Review. Clinic Rev Allerg Immunol 65, 277–329 (2023). https://doi.org/10.1007/s12016-023-08970-4
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Cindy Elizabeth de Lira Quezada Profesor
Dra. Gladis Abigail García García Residente Primer Año
Dra. Alejandra Macías Weinmann Profesor




No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.