 |
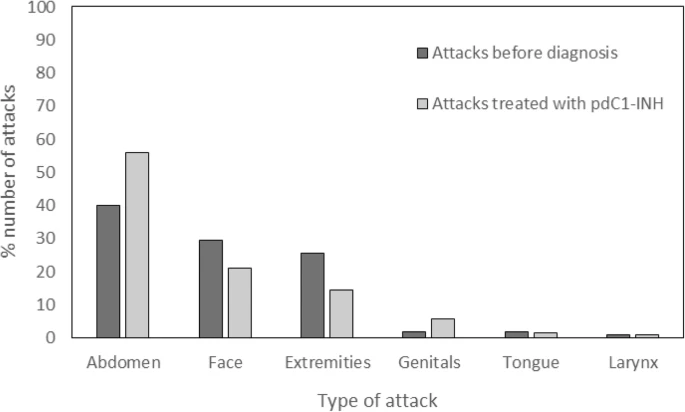
Location of attacks in acquired angioedema C1-inhibitor patients before diagnosis and after
treatment with plasma-derived C1-inhibitor concentrate pdC1-INH = plasma-derived C1-inhibitor.
|
El angioedema adquirido debido a deficiencia del inhibidor de C1 (AEA-Inh-C1) o el angioedema debido a la deficiencia adquirida de INH-C1 se caracteriza por la deficiencia adquirida del Inh-C1, angioedema recurrente e hiperactivación de la vía del complemento. Los pacientes tienen hinchazón o ataques recurrentes de la piel (cara, extremidades y genitales) y ataques abdominales graves, a veces con diarrea y vómitos, debido al edema de la mucosa gastrointestinal. También pueden presentarse con edema de forma potencial mortal del tracto respiratorio superior, la mucosa oral y la lengua. Se reportó muerte por asfixia.
Los ataques suelen durar de 2 a 5 días sin ningún desencadenante aparente. No hay datos epidemiológicos disponibles para AEA-INH-C1, pero se estima que la prevalencia oscila entre 1: 100,000 y 1: 500,000. El AEA-INH-C1 puede asociarse con anormalidades de células B tales como linfoma maligno, gammapatía monoclonal de significado indeterminado (GMSI) y autoanticuerpos anti-INH-C1. A pesar de que el INH-C1 funcional se produce en el AEA-INH-C1, se cree que estos trastornos asociados pueden conducir a una deficiencia de la proteína INH-C1. La deficiencia de INH-C1 conduce a una activación inadecuada del sistema de contacto-cinina, liberación de bradicinina, aumento de la permeabilidad vascular y angioedema. El diagnóstico de AEA-INH-C1 en general ocurre después de los 40 años. No hay asociación genética ni antecedentes familiares de angioedema en el AEA-INH-C1; esto contrasta con los tipos de angioedema hereditario (AEH) que son causados o asociados con mutaciones específicas en los genes que codifican INH-C1, factor XII, plasminógeno o angiopoyetina. Los pacientes con AEA-INH-C1 tienen niveles plasmáticos bajos de INH-C1 (funcional y antigénico) y C4, que en general están por debajo de 50% de lo normal. A diferencia de los pacientes con AEH-INH-C1, la mayoría de los pacientes con AEA-INH-C1 también tienen niveles reducidos de C1q. La presencia de autoanticuerpos anti-INH-C1 y la ausencia de mutaciones genéticas del INH-C1 pueden ayudar en el diagnóstico de AEA-INH-C1. En la actualidad, no existe un tratamiento aprobado para el AEA-INH-C1. Las terapias para el AEH-INH-C1, como el concentrado de INH-C1 derivado del plasma (INH-C1dp) y el antagonista del receptor de bradicinina B2, icatibant, se utilizan para resolver los ataques de AEA-INH-C1. En general, se supone que estos tratamientos a demanda son más efectivos cuando se administran temprano en el ataque. Sin embargo, la información publicada sobre la eficacia y seguridad de los tratamientos con AEA-INH-C1 es limitada y no se estudió de manera sistemática. Por lo tanto, el objetivo de este estudio observacional retrospectivo fue: (1) describir las características y los trastornos asociados de los pacientes con AEA-INH-C1, (2) evaluar la eficacia de INH-C1dp en el tratamiento de pacientes con AEA-INH-C1, (3) evaluar el efecto del tiempo de inyección, dosis y autoanticuerpos anti-INH-C1 sobre la eficacia de INH-C1dp.
Resultados
Características del paciente
Los pacientes con un diagnóstico confirmado de AEA-INH-C1 que asistieron a la clínica ambulatoria, departamento de Dermatología, de la Universidad de Mainz, Alemania (AOSM), fueron elegibles para este estudio observacional. En total, se identificaron 44 pacientes con AEA-INH-C1 y se revisaron y analizaron sus registros de salud. La prevalencia de AEA-INH-C1 en comparación con la de AEH-INH-C1 en la AOSM fue 1: 9.3. La mayoría (61%) de los pacientes eran mujeres y la edad media (DE) de inicio del angioedema recurrente de AEA-INH-C1 fue 56.2 (±14.8) años. Cinco (11.4%) de los 44 pacientes tenían menos de 40 años cuando comenzó el angioedema recurrente. En dos pacientes femeninas apareció a los 21 y 30 años y tenían autoanticuerpos anti-INH-C1; en otro paciente masculino y femenino tuvo inicio a los 37 y 39 años, de forma respectiva y tenían GMSI. El quinto paciente no tenía trastornos asociados. En estos 5 pacientes, las pruebas genéticas moleculares para detectar una mutación en SERPING1 fueron negativas. Los síntomas clínicos fueron ataques abdominales, hinchazón de la piel de la cara, extremidades y genitales, así como hinchazón aislada de la lengua y ataques laríngeos. El eritema marginado precedió los síntomas en 2 pacientes. Siete pacientes murieron durante el curso del estudio; 2 muertes fueron por enfermedades subyacentes. No hubo muertes relacionadas con el angioedema en este grupo.
Trastornos asociados
La búsqueda de trastornos asociados en los 44 pacientes con AEA-INH-C1 reveló lo siguiente:
(1) GMSI se asoció con 21 pacientes (47.7%): IgG (n = 12), IgM (n = 6) e IgA (n = 3). La edad media (EM) al inicio del angioedema en pacientes con GMSI fue 58.5 (±13.5) años.
(2) El linfoma no Hodgkin estuvo presente en 12 (27.3%) pacientes. De estos, 11 (25.0%) pacientes tenían linfoma maligno de grado bajo: linfoma de células marginales esplénicas (n = 6), plasmocitoma (n = 2), linfoma de células B (n = 1), macroglobulinemia de Waldenström (n = 1) y linfoma folicular centroblástico-centrocítico (n = 1). Un paciente (2.3%) tenía linfoma maligno de grado alto: linfoma anaplásico difuso de células B grandes. Seis de los 12 pacientes con linfoma no Hodgkin presentaron gammapatías monoclonales: IgG (n = 3) e IgM (n = 3). La edad media (EM) al inicio del angioedema en pacientes con linfoma no Hodgkin fue 62.4 (±12.3) años.
(3) Cinco (11.4%) pacientes tenían autoanticuerpos anti-INH-C1 y, además del angioedema recurrente, no tenían ningún otro trastorno asociado subyacente. En estos pacientes, el angioedema recurrente comenzó a los 21, 30, 40, 50 y 54 años, con una edad media (EM) al inicio de los 39 (±13.7) años. Es interesante que los pacientes con angioedema con autoanticuerpos anti-INH-C1 y sin ningún otro trastorno eran más jóvenes de forma notable al inicio que los pacientes con GMSI (58.5 (±13.5) años) o linfoma maligno (62.4 (±12.3) años). Durante un período de observación de 15.8 (±9.4) años después de la detección de autoanticuerpos anti-INH-C1, no se encontró GMSI, linfoma u otros trastornos subyacentes además de los autoanticuerpos. Otros 3 pacientes tenían autoanticuerpos anti-INH-C1 y un trastorno asociado subyacente de GMSI (n = 2) y linfoma anaplásico difuso de células B grandes (n = 1).
(4) Dos pacientes (4.5%) tenían otros trastornos asociados: cáncer de seno (n = 1) e insuficiencia hepática (n = 1).
(5) Los 4 pacientes restantes (9.1%) no tenían trastornos asociados, como GMSI, linfoma no Hodgkin, autoanticuerpos anti-INH-C1, cáncer o insuficiencia hepática. Tres de los 4 pacientes tenían actividad y proteínas bajas del INH-C1, C4 bajo y C1q bajo en plasma. Uno de los 4 pacientes, una mujer, tuvo angioedema recurrente de las extremidades y labios y ataques abdominales por 17 años (de la edad de 25 a 42 años). Durante este tiempo, la paciente tenía función baja de la proteína INH-C1 y C4 bajo pero C1q normal. Durante los últimos 4 años, la paciente no tuvo síntomas clínicos y las 6 pruebas para la función y la proteína INH-C1 y C4 revelaron resultados normales.
No se pudieron identificar mutaciones en el gen SERPING1 y no hubo antecedentes familiares de angioedema. Los padres del paciente tenían función y proteína INH-C1 normales. En 18 pacientes, el angioedema recurrente estuvo presente más de 1 año antes de que se diagnosticara un trastorno asociado, en 23 pacientes ambos se diagnosticaron al mismo tiempo y en 3 pacientes, el angioedema recurrente se desarrolló más tarde que el trastorno asociado. En 9 (75.0%) de 12 pacientes, el linfoma maligno asociado se detectó luego del diagnóstico de AEA-INH-C1. En los otros 3 pacientes, el linfoma subyacente ya se conocía antes de la primera visita a la AOSM.
Complemento plasmático
Los 44 pacientes tenían niveles plasmáticos funcionales y antigénicos de INH-C1 que estaban por debajo del rango normal. Los niveles de C4 también estuvieron por debajo del rango normal en todos los pacientes; Los niveles de C1q estaban por debajo de los niveles normales en 39 (88.6%) pacientes.
Tratamiento previo y concomitante
Antes del inicio del tratamiento con INH-C1dp (Berinert® (CSL Behring, Marburg, Alemania)), los pacientes recibieron terapia profiláctica con profilaxis oral: danazol (10 [22.7%] pacientes), ácido tranexámico (10 [22.7 %] pacientes) y antihistamínicos (1 [2.3%] pacientes). Los ataques agudos se trataron con icatibant (11 [25.0%] pacientes), cortisona (10 [22.7%] pacientes) y antihistamínicos (2 [4.5%] pacientes). Se administraron rituximab (5 [11.4%] pacientes) y clexanos (2 [4.5%] pacientes) para el tratamiento a largo plazo de las inflamaciones. Los pacientes pasaron en promedio 2.8 (±4.5) estancias en el hospital y 0.82 (±2.7) días en cuidados intensivos para el tratamiento de los ataques agudos antes del tratamiento con INH-C1dp. Tres pacientes tuvieron una intubación cada uno y 2 pacientes tuvieron 2 intubaciones cada uno. Tres pacientes se sometieron a un procedimiento de cricotirotomía. Durante el período de tratamiento con INH-C1dp, los pacientes continuaron usando de forma ocasional icatibant para tratar los ataques agudos (11 [25.0%] pacientes). También se administraron rituximab (5 [11.4%] pacientes) y clexanos (2 [4.5%] pacientes) durante la fase de tratamiento con INH-C1dp.
Tratamiento con concentrado de inhibidor de C1 derivado de plasma
Ataques, duración del tratamiento y dosis
El grupo de tratamiento con INH-C1dp se compuso por 32 pacientes. Se experimentaron un total de 1962 ataques antes del diagnóstico en este grupo, en el abdomen (785 [40%]), cara (580 [29.6%]), extremidades (504 [25.7%]), genitales (36 [1.8%]), lengua (35 [1.8%]) y laringe (22 [1.1%]). Estos pacientes recibieron INH-C1dp durante una media (DE) de 82.6 (±80.1) meses. Se trataron por 3636 ataques que ocurrieron sobre todo en el abdomen (2522 [56.1%]), la cara (954 [21.2%]) y las extremidades (650 [14.5%]) . Un número menor (367 [8.2%]) de ataques que ocurrieron en los genitales, la lengua y la laringe también se trataron. El INH-C1dp se administró en la dosis de 500 U para 2203 ataques y la dosis de 1000 U para 1095 ataques. Un total de 338 ataques se trataron con dosis más altas de 1500 U, 2000 U o 3000 U..
Eficacia del tratamiento con concentrado de INH-C1dp
La duración media (DE) de los ataques no tratados fue 89.9 (±14,8) horas sobre todos los ataques en los 32 pacientes y 84 (±31.8) horas por paciente (media de 32 promedios). La duración media (DE) de los ataques tratados fue 27.9 (±12.9) horas sobre todos los ataques en los 32 pacientes y 29.6 (±16.4) horas por paciente. El tratamiento con el concentrado de INH-C1dp acortó los ataques en un promedio de 54.4 (±32.8) horas (intervalo de confianza [IC]: 42.5, 66.2) (P < 0.0001) por paciente (es decir, en 64.8%). Los 32 pacientes respondieron al tratamiento, y 12 (37.5%) pacientes experimentaron alivio en 30 minutos o menos. El tiempo promedio para el primer alivio después de la inyección fue de 1.0 (±3.3) horas en los 32 pacientes y 3.6 h (±8.2) por paciente. La resolución de los síntomas ocurrió en promedio 26.4 (±12.6) horas después de la inyección en los 32 pacientes y 26.7 (±15.0) horas por paciente. Un total de 3553 (97.7%) de los 3636 ataques se trataron de forma efectiva según lo evaluado por el paciente. Ochenta y ocho (2.3%) ataques en 8 pacientes no respondieron o no respondieron lo suficiente al tratamiento con INH-C1dp. Entre los 8 no respondedores había 4 pacientes con autoanticuerpos anti-INH-C1 (descritos más adelante).
Efecto en el tiempo de la eficacia de la inyección
El tiempo medio (DE) entre el inicio del ataque y la inyección fue 1.5 (±0.9) horas para los 32 pacientes y 3.0 (±2.7) horas por paciente. El análisis de regresión mostró que había una asociación lineal entre el tiempo promedio para completar la resolución de los síntomas y el tiempo promedio para la inyección, es decir, cuanto antes se tratara el ataque, más corto es el tiempo entre la inyección y la resolución de los síntomas (P = 0.0149). El análisis de sensibilidad, con omisión de 2 pacientes con tiempos extremos para la inyección, confirmó la asociación (P = 0.0036). Un análisis de regresión similar no mostró una asociación clara entre el acortamiento promedio de la duración del ataque y el tiempo de inyección (P = 0.0745).
Efecto de la dosis sobre la eficacia
Para analizar el efecto de la dosis, se realizó un análisis de subgrupos de pacientes que usaron 500 U o ≥1000 U en al menos 90% de sus inyecciones agudas. En general, la dosis media (DE) por ataque fue de 787 (± 442) U. La mayoría de los pacientes recibieron 500 U (n = 13) o 1000 U (n = 9) en más del 90% de los ataques; 1 paciente recibió 1500 U y 1 paciente recibió 2000 U. Las dosis de los pacientes en ambos subgrupos tuvieron pesos corporales y tiempos medios similares entre el inicio del ataque y la inyección. En el grupo de dosis de 500 U, la duración del ataque se acortó en una media (DE) de 53.1 (±25.9) horas y en el grupo de dosis ≥1000 U en una media (DE) de 58.8 (±40.1) horas. En el grupo de dosis de 500 U, el tiempo entre la inyección y la resolución de los síntomas fue 27.6 (±16.3) horas y en el grupo de dosis de ≥1000 U fue 21.9 (± 11.3) horas. Sin embargo, no hay asociación entre la dosis y el acortamiento de la duración del ataque (P > 0.1) o la dosis y el tiempo entre la inyección y la resolución de los síntomas (P > 0.1) podrían mostrarse mediante regresión lineal.
Efecto de los autoanticuerpos anti-INH-C1 sobre la eficacia
Ocho pacientes AEA-INH-C1 fueron positivos para autoanticuerpos anti-INH-C1 y 6 pacientes fueron negativos. El resto de los pacientes no se evaluaron para detectar la presencia de autoanticuerpos anti-INH-C1. La duración del ataque se acortó en una media (DE) de 50.4 (±38.2) horas en los 8 pacientes que dieron positivo para anticuerpos contra INH-C1 y 58.9 h (±36.0) en los 6 pacientes que dieron negativos. El tiempo medio (DE) entre la inyección y la resolución de los síntomas fue 31.5 (±21.1) horas en los pacientes con anticuerpos positivos y 29.3 (±17.5) horas en los pacientes con anticuerpos negativos.
Los 8 pacientes con anticuerpos positivos tuvieron un total de 2963 ataques: 1634 no se trataron y 1329 se trataron con INH-C1dp. En los 8 pacientes, el INH-C1dp fue eficaz en 1246 ataques (93.8%). En 4 de los 8 pacientes, el INH-C1dp no fue efectivo en 83 ataques. Estos 4 pacientes tuvieron 95 ataques adicionales que se trataron de forma efectiva con el INH-C1dp. Cinco de los 8 pacientes con autoanticuerpos anti-INH-C1 positivos (pacientes 1, 2, 3, 7, 8) no tenían trastornos asociados como GMSI o linfoma maligno. Estos pacientes experimentaron 986 ataques, 971 (98.5%) de los cuales se trataron de forma efectiva, según lo evaluado por el paciente.
En 6 pacientes sin autoanticuerpos anti-INH-C1, 344 (99.4%) de 346 ataques se trataron de manera efectiva, con una dosis promedio (DE) de 510.2 (±69.1) U por ataque tratado de forma efectiva. En 8 pacientes con autoanticuerpos anti-INH-C1, 1246 (93.8%) de los 1329 ataques se trataron de manera efectiva, con una dosis promedio (DE) de 1238.4 (±578.2) U por ataque tratado de forma efectiva. En 4 de los 8 pacientes con autoanticuerpos anti-INH-C1 positivos, 83 ataques no respondieron o no respondieron lo suficiente al INH-C1dp. Sesenta y nueve (83.1%) de esos 83 ataques se trataron con 500 U. Sin embargo, una dosis de 500 U trató de manera efectiva 33 (32.4%) del total de 102 ataques.
Discusión
Las características clínicas de los pacientes diagnosticados con AEA-INH-C1 fueron similares a las descritas en estudios previos de AEA-INH-C1. En esta institución, se encontró que la incidencia de la condición fue de 1 paciente con AEA-INH-C1 por cada 9..3 pacientes con AEH-INH-C1. En otros estudios, se reportó una incidencia de 1: 8.8, 6% y 10%. El cuadro clínico de los pacientes con AEA-INH-C1 difiere de una gran serie de pacientes con AEH-INH-C1 antes descritos. Los pacientes con AEA-INH-C1 tuvieron (1) un mayor número de inflamaciones faciales (29.6% versus 1..6%), (2) un menor número de hinchazones de las extremidades (25.7% versus 45.1%) y (3) un mayor número de hinchazones en la lengua (1.8% versus 0.3%) que los pacientes con AEH-INH-C1. La diferencia en los patrones de hinchazón entre AEA-INH-C1 y AEH-INH-C1 muestra que un nivel bajo de actividad funcional de INH-C1 por sí sola no determina el patrón de hinchazón. Además, el número de pacientes con eritema marginado anterior es menor en pacientes con AEA-INH-C1 (4.5%) que en pacientes con AEH-INH-C1 (30 a 60%). En la mayoría de los pacientes de esta serie, el inicio de AEA-INH-C1 ocurrió a los 40 años o más. Sin embargo, hubo algunos pacientes que tenían menos de 40 años cuando inició el AEA-INH-C1. Entre estos había 3 pacientes con autoanticuerpos anti-INH-C1 pero sin GMSI o linfoma maligno. Se concluye, por lo tanto, que no se puede descartar un diagnóstico de AEA-INH-C1 en pacientes menores de 40 años. Se encontró que AEA-INH-C1 se asoció con una variedad de trastornos que incluyen GMSI, linfoma no Hodgkin maligno, autoanticuerpos anti-C1INH y otras afecciones. En algunos pacientes, no hubo un trastorno asociado identificable. Un total de 27.3% de los pacientes tenía un linfoma subyacente y en 75.0% de esos pacientes el linfoma se detectó mediante el monitoreo de los signos del AEA-INH-C1. Esto subraya la importancia del diagnóstico precoz de AEA-INH-C1. También se reportó que 25.0% de los pacientes tenían un linfoma maligno de grado bajo y casi la mitad de ellos tenía un linfoma de células marginales esplénicas. Esto confirma que el linfoma de células marginales esplénicas es el tipo más común de linfoma subyacente en pacientes con AEA-INH-C1.
La GMSI y el linfoma no Hodgkin son trastornos linfoproliferativos de las células B. La GMSI puede transformarse en plasmocitoma, macroglobulinemia de Waldenström y otros trastornos linfoproliferativos. No está claro cómo los trastornos linfoproliferativos resultan en deficiencia de INH-C1. La unión de INH-C1 a la desproteína de GMSI o de forma directa al tejido de linfoma podría conducir a un nivel bajo de INH-C1. El papel que desempeñan los autoanticuerpos anti-INH-C1 en la deficiencia de INH-C1 es menos claro. Un total de 11.4% de los pacientes en esta serie tenía autoanticuerpos anti-INH-C1 sin GMSI, linfoma u otro trastorno asociado, incluso después de un período largo de observación de 15.8 años. Los resultados muestran que la GMSI puede ser la base del AEA-INH-C1 con y sin autoanticuerpos anti-INH-C1 y, también, que el linfoma maligno puede ser la base del AEA-INH-C1 en presencia o ausencia de disproteínas o autoanticuerpos anti-INH-C1. Algunos pacientes con AEA-INH-C1 sólo tienen autoanticuerpos neutralizantes para el INH-C1 y ningún otro trastorno asociado. En el pasado, se suponía que este era un tipo separado de AEA-INH-C1 (AEA-INH-C1 tipo 2). La edad más temprana del inicio del angioedema descrita aquí podría ser una característica especial de este subgrupo de pacientes. Sin embargo, debe considerarse el número pequeño de pacientes. En la actualidad, no está claro si los trastornos linfoproliferativos (GMSI y linfoma) y los autoanticuerpos anti-INH-C1 tienen un mecanismo patogénico común que conduce a la deficiencia de INH-C1. Estos resultados mostraron que el INH-C1dp reduce la duración promedio del ataque en más de 60%. Es muy efectivo en la resolución de los ataques, según lo evaluado por el ataque y el análisis del paciente, en especial si el tratamiento se administra temprano en un ataque. Según la autoevaluación de los pacientes, todos los pacientes respondieron bien al INH-C1dp en casi todos sus ataques.. Se reportó que algunos pacientes con AEA-INH-C1 necesitaron tratamiento con dosis altas de INH-C1dp o que algunos pacientes se volvieron resistentes de forma total o parcial a este tratamiento. Algunos de estos pacientes tenían autoanticuerpos contra el concentrado de INH-C1. En contraste, estos resultados muestran que la gran mayoría (93.8%) de los ataques en pacientes con autoanticuerpos anti-INH-C1 respondieron bien al INH-C1dp y que la tasa de respuesta fue similar a la de los pacientes sin autoanticuerpos anti-INH-C1 (99.4% de ataques). Por lo tanto, se concluye que los pacientes con anticuerpos anti-INH-C1 pueden responder al INH-C1dp. Sin embargo, en algunos pacientes con autoanticuerpos anti-INH-C1, las dosis para tratar de forma eficaz los ataques deben ser más del doble que en pacientes sin autoanticuerpos. En esta serie, 4 de 8 pacientes con autoanticuerpos anti-INH-C1 no respondieron lo suficiente al tratamiento con INH-C1dp en algunos ataques, mientras que en otros ataques en los mismos pacientes, el tratamiento con INH-C1dp fue efectivo. Una variación en el nivel de los autoanticuerpos anti-INH-C1 puede ser una razón para esto. Se necesitan investigaciones repetidas y a largo plazo de los niveles de autoanticuerpos anti-INH-C1 en pacientes con AEA-INH-C1 para explicar la relación entre el nivel de autoanticuerpos y la dosis de tratamiento. Dada la prevalencia baja del trastorno, éste es un estudio observacional grande de forma relativa que examina las características clínicas de AEA-INH-C1. El estudio reclutó un número considerable de pacientes y registró los detalles de una gran cantidad de ataques tratados con INH-C1dp durante un período largo de tiempo. El estudio está limitado por su diseño de estudio observacional y retrospectivo que involucra la recuperación de datos de los informes de los pacientes, lo que puede resultar en algún sesgo. El hecho de que no en todos los pacientes se probaron autoanticuerpos anti-INH-C1, también limitó los resultados.
Conclusiones
En resumen, este estudio demostró que los síntomas clínicos de AEA-INH-C1 son similares a los de AEH-INH-C1.. El diagnóstico temprano de AEA-INH-C1 es importante debido al riesgo de asfixia por edema laríngeo y a que el AEA-INH-C1 se asocia de forma frecuente con un trastorno maligno subyacente. Los ataques de AEA-INH-C1 se pueden tratar con INH-C1dp, que es de acción rápida y muy eficaz en casi todos los ataques de AEA-INH-C1, incluidos aquellos pacientes con autoanticuerpos anti-INH-C1.
Métodos
Pacientes
Los pacientes de este estudio observacional se siguieron en la AOSM desde marzo de 1986 hasta agosto de 2017. El diagnóstico de AEA-INH-C1 se basó en los antecedentes personales de angioedema recurrente, sin antecedentes familiares de angioedema y exámenes en plasma de INH-C1, C4 y C1q. La ausencia de una mutación genética de INH-C1 (SERPING1) confirmó el diagnóstico en algunos pacientes. El estudio se aprobó por el comité local de ética (Comité de Ética del Landesärztekammer Rheinland-Pfalz, 837.413.13 (9098-F)) y todos los pacientes dieron su consentimiento informado para participar en el estudio.
Diseño del estudio
Los registros clínicos de salud de 44 pacientes con AEA-INH-C1 se revisaron de forma retrospectiva y se observaron las características de los pacientes. Treinta y dos de estos pacientes se trataron por ataques agudos con INH-C1dp. Las variables de eficacia se definieron de la siguiente manera: (1) la duración acortada de los ataques después del tratamiento, (2) el tiempo entre la inyección y la resolución de los síntomas, y (3) la eficacia del tratamiento evaluada por el paciente. La duración de los ataques tratados se comparó con la duración de los ataques no tratados en los mismos individuos. Los ataques no tratados se definieron como los que ocurrieron antes de la primera administración de INH-C1dp. Los ataques tratados se definieron como los tratados con INH-C1dp.. La duración del ataque se definió como el tiempo entre el inicio del ataque y la resolución de los síntomas. Los datos sobre el tiempo de inyección y el tipo y la duración de los ataques se registraron mediante cuestionarios estandarizados. El curso de los ataques se dividió en el primer alivio de los síntomas y la resolución completa de los síntomas. Además, los pacientes evaluaron la efectividad del tratamiento ellos mismos durante las entrevistas y/o lo documentaron en un diario del paciente. Los pacientes registraron las siguientes evaluaciones de tratamiento: tratamiento efectivo (respondedores) y tratamiento que no fue efectivo de forma suficiente (no respondedores).
Tratamiento
El grupo de tratamiento recibió el concentrado de INH-C1dp pasteurizado por vía intravenosa (Berinert® (CSL Behring, Marburg, Alemania)) que se autoinyectó o administró por el médico general del paciente, en su hospital local o en el departamento. La dosis habitual comprendía 500 U de INH-C1dp, que corresponde a una actividad plasmática de INH-C1 de un aproximado de 500 ml de plasma fresco. Para el tratamiento de las inflamaciones de la piel, se recomendaron 500 U INH-C1dp. Si el paciente tenía un peso corporal superior a 80 kg o si el paciente sentía que la dosis de 500 U no era efectiva de forma suficiente, se administraban 1000 U INH-C1dp. Se aconsejó a los pacientes que no se trataran las inflamaciones leves de la piel. Las inflamaciones leves de la piel se definieron como hinchazones limitadas al dorso de una mano o pie o hinchazones en una extremidad o en el tronco con un diámetro de <20 cm. Se recomendó el tratamiento para todas las inflamaciones faciales y genitales. En las inflamaciones cutáneas de las extremidades, el tratamiento sólo se recomendaba cuando las inflamaciones tenían >20 cm de diámetro o si la extremidad entera estaba afectada o cuando la hinchazón de una extremidad se seguía por una hinchazón de otra extremidad o partes del tronco dentro de las 24 horas. Las dosis superiores a 1000 U se administraron sólo si la respuesta clínica no fue suficiente. Todos los pacientes recibieron la vacuna contra el virus de la hepatitis B.
Métodos de laboratorio
La función del INH-C1 se determinó con el sustrato cromogénico C2H5CO-Lys (e-Cbo) -Gly-Arg-pNA (Immunochrom INH-C1, Technoclone, Viena, Austria). Los niveles funcionales normales de INH-C1 se definieron como 70-130%. Los niveles antigénicos de INH-C1, C4 y C1q se cuantificaron por inmunodifusión radial. Los niveles de proteínas plasmáticas se consideraron normales si se encontraban dentro de los siguientes rangos: INH-C1 = 15.4–33.8 mg/dL, C4 = 16.4–31.3 mg/dL, y C1q = 0.1–0.25 g/L. Los autoanticuerpos contra INH-C1 se midieron como se describió antes.
Análisis estadístico
Características del paciente
Los siguientes parámetros se analizaron con estadísticas univariadas (media y DE) o tablas de frecuencias, según sea apropiado, para todos los pacientes y pacientes tratados con INH-C1dp: características basales y demográficas, trastornos asociados, anticuerpos de gammapatía monoclonal, autoanticuerpos anti-INH-C1, tratamiento previo y concomitante, número de estadías en el hospital debido a angioedema, número de estadías en la unidad de cuidados intensivos, cantidad de intubaciones, cantidad de inflamaciones no tratadas y duración promedio de los ataques no tratados. También se generaron estadísticas univariadas para la función INH-C1, proteína INH-C1, C4 y C1q en la primera visita a AOSM para todos los pacientes y para los pacientes tratados con INH-C1dp.
Tratamiento concentrado de C1 inhibidor derivado de plasma
Se aplicaron estadísticas univariadas para dosis únicas de INH-C1dp tanto para el análisis por ataque como para el análisis por paciente (en dosis promedio). El número de ataques tratados con INH-C1dp, la duración del tratamiento con INH-C1dp y la edad de la última inyección de INH-C1dp se analizaron con estadísticas univariadas en un análisis por paciente. El número de ataques en diferentes sitios y el número de ataques tratados con diferentes dosis de INH-C1dp se analizaron con una tabla de frecuencias y estadísticas de gráficos de frecuencia en un análisis por ataque. Además, se generó un análisis por paciente para mostrar el número de pacientes que de forma preferible (es decir, en 90% o más de sus ataques) recibieron una dosis única especial de INH-C1dp. Para el tiempo entre el inicio del ataque y la inyección, el tiempo entre la inyección y el primer signo de eficacia, el tiempo entre la inyección y la resolución completa de los síntomas, y el acortamiento promedio de los ataques con tratamiento, se generaron estadísticas univariadas tanto por paciente como ataque por paciente.
Variables de eficacia
El conjunto original de datos incluía datos sobre la duración promedio de los ataques con y sin tratamiento con INH-C1dp para cada paciente, así como el número de ataques para cada paciente. El análisis primario sobre la duración del ataque fue, por lo tanto, un análisis por paciente que proporcionó estadísticas sobre la duración promedio del ataque en todos los pacientes tratados. Además, se realizó un análisis descriptivo por ataque para ponderar la duración promedio individual de los ataques por el número individual de ataques (no tratados y tratados). Se aplicaron estadísticas univariadas para la duración promedio del ataque tratado con INH-C1dp y para la duración promedio de los ataques no tratados tanto en un análisis por paciente como en un análisis por ataque. Para el acortamiento promedio de la duración de los ataques, se generaron las siguientes estadísticas: estadísticas univariadas, una prueba de rango con signo de Wilcoxon de dos lados (hipótesis: no acortamiento) y un IC de 90% en un análisis por paciente. Para investigar la asociación entre el tiempo entre la inyección y la resolución de los síntomas y en el tiempo transcurrido entre el inicio del ataque y la inyección, se generó un análisis de regresión lineal con representación gráfica. Se realizó un análisis de regresión similar para la asociación entre el acortamiento promedio de los ataques y el tiempo de inyección, la asociación entre el acortamiento de los ataques y la dosis única preferida y la asociación entre el tiempo hasta la resolución de los síntomas y la dosis única preferida. El porcentaje de ataques tratados de forma eficaz, según lo evaluado por el paciente, se calculó por el número total de ataques tratados, pacientes con anticuerpos anti-INH-C1 positivos, pacientes con anticuerpos anti-INH-C1 positivos con GMSI y pacientes con anticuerpos anti-INH-C1 negativos. Todos los análisis se realizaron con Excel o SAS.
Angioedema due to acquired C1-inhibitor deficiency: spectrum and treatment with C1-inhibitor concentrate
14, Article number: 65 (2019)
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Profesor
Dr. Carlos Macouzet Sánchez Profesor
Dra. Ligia Libeth Carrasco Díaz Residente 1er Año
Dra. Alejandra Macías Weinmann Profesor



No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.