INTRODUCCIÓN La rinitis alérgica (RA) se caracteriza por una inflamación nasal sensible, que se estima que ya afecta 10%-40% de la población mundial. Los síntomas comunes de RA son picazón nasal, estornudos, rinorrea y congestión nasal. Además, algunos pacientes experimentan síntomas de rinoconjuntivitis alérgica, como ojos llorosos, picazón o enrojecimiento. La RA grave puede afectar la calidad de vida, el sueño y el rendimiento laboral.
En 1989, Strachan descubrió que el número de hermanos se relacionaba de forma inversa con la prevalencia de la fiebre del heno entre sus pares en el Reino Unido. Luego, propuso la “hipótesis de la higiene”, que la microbiota intestinal alterada por la falta de contacto con fuentes infecciosas, parásitos y microorganismos simbióticos afecta el desarrollo normal del sistema inmunológico. La “hipótesis de la higiene” se extiende a los “viejos amigos” y a la “hipótesis de la microflora”. La “hipótesis de la microflora” cree que una microbiota intestinal diversa desempeña un papel importante en la formación del desarrollo inmunitario del huésped y que la alteración o disbiosis de la microbiota intestinal normal contribuye al desarrollo de trastornos inmunitarios como las enfermedades alérgicas. La simbiosis de los microbios del huésped desempeña un papel fundamental en el mantenimiento de la salud y la homeostasis inmunitaria. Los cambios en la flora intestinal se consideran uno de los indicadores más importantes de enfermedades alérgicas. Los probióticos son bacterias vivas que colonizan el tracto gastrointestinal y proporcionan un beneficio para la salud del huésped cuando se administran en cantidades adecuadas. Estudios recientes demostraron que los probióticos son agentes no farmacéuticos que pueden aumentar la producción sistémica de IFN, IL10 e IL12, mejorar la respuesta inmune pre-Th1 y reducir las citocinas Th2, por lo que se propusieron como moduladores de la respuesta alérgica y como intervenciones terapéuticas y preventivas para las enfermedades alérgicas.
Los probióticos incluyen el grupo Lactobacillus (L. rhamnosus GG, L. sporogenes, L. reuteri RC-14, L. plantarum 299v, L. acidophilus y L. lactis), el grupo Bifidobacterium (B. bifidum, B. longum y B. infantis), el grupo Streptococcus (S. thermophilus, S. lactis y S. fecalis) y organismos no bacterianos (levadura no patógena Saccharomyces boulardii). Los probióticos más comunes son los grupos Lactobacillus y Bifidobacterium. Muchos estudios demostraron evaluar el papel de los probióticos en el tratamiento de la RA con resultados inconsistentes. Mientras que algunos encontraron un efecto protector de los probióticos en la RA, varios otros no encontraron asociación. Dado que se encontraron más estudios publicados, se realizó una revisión sistemática y un metaanálisis con el objetivo de abordar el efecto y la seguridad de los probióticos en la RA y, mientras tanto, se intentaron explorar las posibles causas de la heterogeneidad entre estudios por medio de subgrupos.
MÉTODOS Y ANÁLISIS
Registro de estudios
El protocolo de esta revisión sistemática y metaanálisis se registró en la plataforma PROSPERO con un número de registro asignado CRD42021242645, según las pautas de Declaración de Elementos de Informe Preferidos para Revisiones Sistemáticas y Protocolos de Metaanálisis. Esta investigación se llevó a cabo de acuerdo con este protocolo. Búsqueda de base de datos. Se realizó una búsqueda en MEDLINE (PubMed), Embase y el Registro Cochrane Central de Ensayos Controlados. Se buscaron estudios adicionales mediante la verificación manual de las referencias de los estudios incluidos y las revisiones relevantes. Las búsquedas se limitaron a las publicaciones que aparezcan desde el inicio hasta el 1 de junio de 2021. Se usaron los temas (“Rinitis, alérgica”, “Rinitis, alérgica, estacional”, “Rinitis, alérgica, perenne”, “prebióticos”, “probióticos”) y palabras libres (“Rinitis alérgica estacional”, “Alergia al polen”, “Polinosis”, “Fiebre del heno”, “rinitis alérgica”, “Rinitis alérgica perenne”, “prebióticos”, “probióticos”) para buscar en las bases de datos antes mencionadas. La estrategia de búsqueda fue la siguiente, en la cual tomaron como ejemplo PubMed:
(1) (Rinitis alérgica estacional [Términos MeSH]) O (Rinitis alérgica perenne [Términos MeSH]) O (Rinitis alérgica, estacional) O (Rinitis alérgica, estacional) O (Rinitis, alérgica estacional) O (Rinitis, alérgica estacional) O (Rinitis alérgica estacional) O (Alergia al polen) O (Alergias al polen) O Alergia al polen) O (Alergias al polen) O (Polinosis) O (Polinosis) O (Fiebre del heno) O(Fiebre del heno ) O (Rinitis Alérgica Perenne) O (Rinitis Alérgica, Perenne).
(2) (Probióticos [Términos MeSH]) O (Prebióticos [Términos MeSH]) O (Probióticos) O (Prebióticos).
(3) (1) Y (2).
Criterios elegibles
Los estudios se incluyeron si cumplían con todos los siguientes criterios (1: diseño del estudio: estudios experimentales (ensayos controlados aleatorios y cuasialeatorios) (2); participantes del estudio: participantes con RA (3); intervención: los grupos de intervención deben recibir suplementos de probióticos en cualquier dosis o régimen según lo decidan los autores de los ensayos respectivos (4); comparador(es)/control: los participantes en el/los grupo(s) de comparación podrían recibir un placebo u otros fármacos (5); si se usaron otros medicamentos en el grupo de tratamiento, también deben usarse en el grupo de control de la misma manera, (6) idioma: artículos publicados en idioma inglés.
Se excluyeron los artículos si se publicaron en forma de resumen de congreso, reporte de caso, serie de casos, carta al editor, correspondencia, editorial, revisiones narrativas, revisiones sistemáticas y metaanálisis.
Selección de estudios y extracción de datos
Dos investigadores revisaron de forma independiente los títulos, resúmenes y artículos de texto completo de acuerdo con los criterios de inclusión y exclusión mencionados de forma previa. Los desacuerdos se resolvieron mediante discusión o con un tercer investigador. Los mismos dos investigadores extrajeron los siguientes datos de cada estudio seleccionado: características de la literatura (nombre del primer autor, revista, año de publicación y diseño del estudio); información de los participantes (edad y tamaño de la muestra); información de la intervención (duración de la intervención y componentes del grupo de comparación); resultado (RA y eventos adversos relacionados); y conclusión.
Evaluación del riesgo de sesgo
La evaluación del riesgo de sesgo se realizó mediante el programa La herramienta Cochrane de Riesgo de Sesgo versión 1 en el programa Review manager 5.3.4 por CL y ML. Cualquier desacuerdo se resolvió mediante consulta con el autor SP.
Análisis estadístico
Los análisis estadísticos se completaron con el programa Review Manager 5.3.4 (RevMan; Versión 5.3.4. Copenhague, Dinamarca: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014). Se eligió la diferencia de medias (DM) y la diferencia de medias estandarizada (DME) para los resultados continuos. La DM es la diferencia entre las dos medias, lo que elimina la influencia del valor absoluto entre múltiples estudios. La DME puede entenderse de forma simple como el cociente de la diferencia entre las dos medias dividida por la desviación estándar combinada, lo que no sólo elimina la influencia del valor absoluto de múltiples estudios, sino que también elimina los diferentes efectos de múltiples unidades de medición de estudio. La heterogeneidad estadística se juzgó con el índice de inconsistencia (I2), y se reportó heterogeneidad significativa si el I2 es superior a 50%. El modelo de efectos fijos se utilizó en este metaanálisis ya que los estudios con muestras más grandes recibirán mayor peso y proporcionarán mayores contribuciones a los efectos agrupados. Se realizaron análisis de subgrupos para explorar el origen de la heterogeneidad. La evaluación del sesgo de publicación se realizó por medio de gráficos en embudo si se incluían más de 10 ensayos. Se utilizó el análisis de sensibilidad para explorar la estabilidad de los resultados. Se utilizó el Grupo de Trabajo de Clasificación de Evaluación, Desarrollo y Evaluación de Recomendaciones (GRADE) para evaluar la calidad de la evidencia para los resultados en todos los estudios.
RESULTADOS
Resultados de la búsqueda en la base de datos
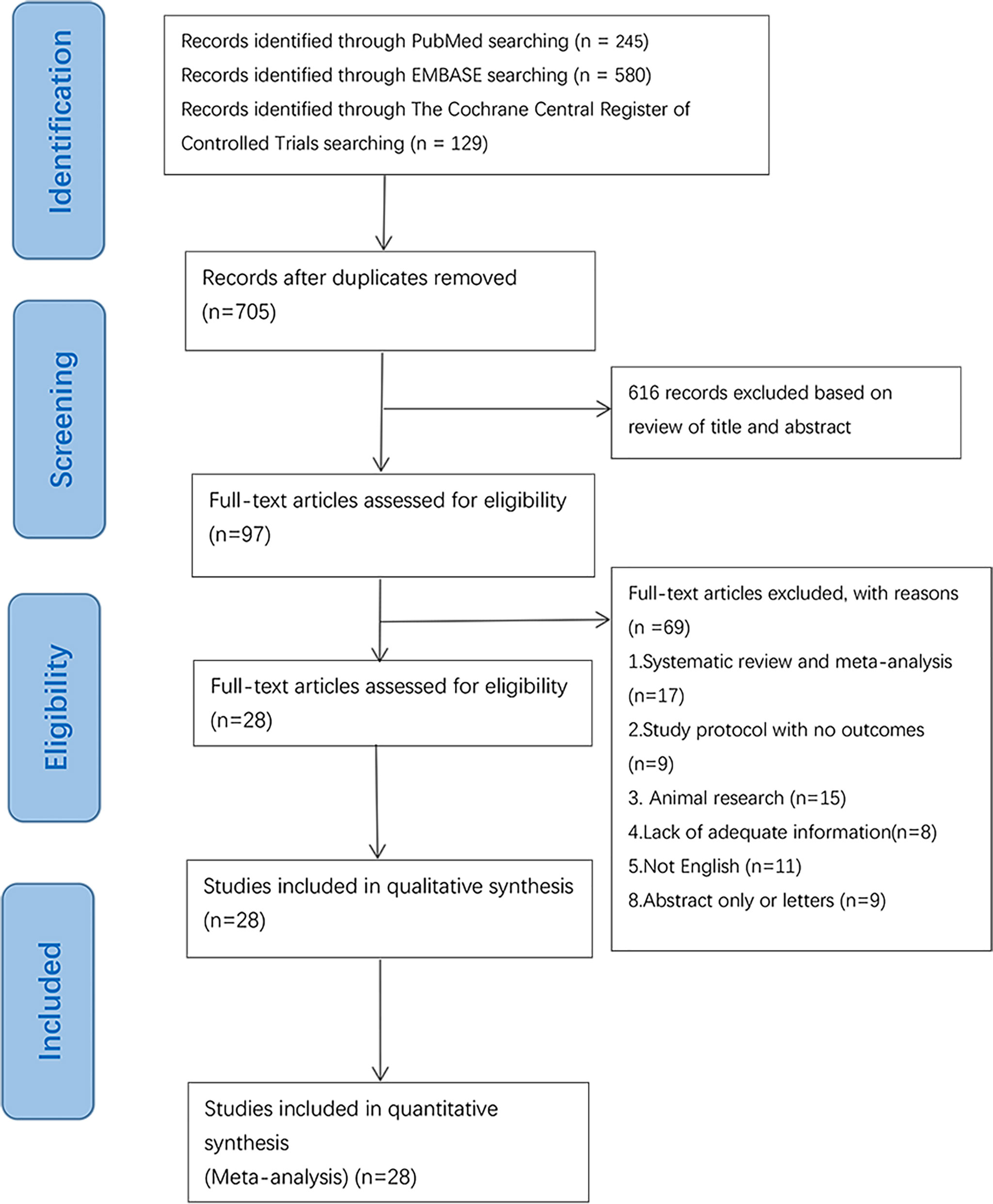
La búsqueda inicial se completó el 1 de junio de 2021. Se identificaron 245 publicaciones relevantes de forma potencial de PubMed, 580 de Embase y 129 del Registro Cochrane Central de Ensayos Controlados. Endnote se utilizó para eliminar publicaciones duplicadas, lo que resultó en 97 registros para revisión. Después de excluir las publicaciones que no cumplían con los criterios de inclusión o exclusión, se incluyeron 28 estudios para revisión sistemática y metaanálisis. Un diagrama de flujo que ilustra la exclusión de artículos con razones específicas se muestra en la Figura 1 (diagrama de flujo PRISMA).
Características del estudio
Veintiocho ensayos se incluyeron en el análisis sistemático y el metaanálisis. Las principales características de los estudios individuales se muestran en la Tabla 1. En general, uno de estos estudios controlados aleatorizados (ECA) fue un estudio multicéntrico. Veintiocho estudios incluyeron pacientes de 2 a 65 años. Quince estudios incluyeron adultos (edad >18 años) y once estudios incluyeron niños o adolescentes (edad <18 años) y dos estudios incluyeron adultos y niños. Catorce estudios incluyeron pacientes con rinitis alérgica estacional (RAE). Once estudios incluyeron pacientes con rinitis alérgica perenne (RAP) y tres estudios incluyeron pacientes con RAE y RAP. El grupo de intervención de catorce estudios utilizó cepas de Lactobacillus, y cuatro estudios utilizaron cepas de Bifidobacterium. Tres estudios utilizaron tanto cepas de Bifidobacterium como de Lactobacillus. Los otros tres estudios utilizaron Tetragenococcus halophilus Th22, E. coli Nissle 1917 y Broncho-Vaxom. Tres estudios utilizaron probióticos combinados con antihistamínicos. Un estudio utilizó cepas de Bifidobacterium y Enterococcus faecium. El tiempo de tratamiento con probióticos osciló entre 6 semanas y 6 meses.
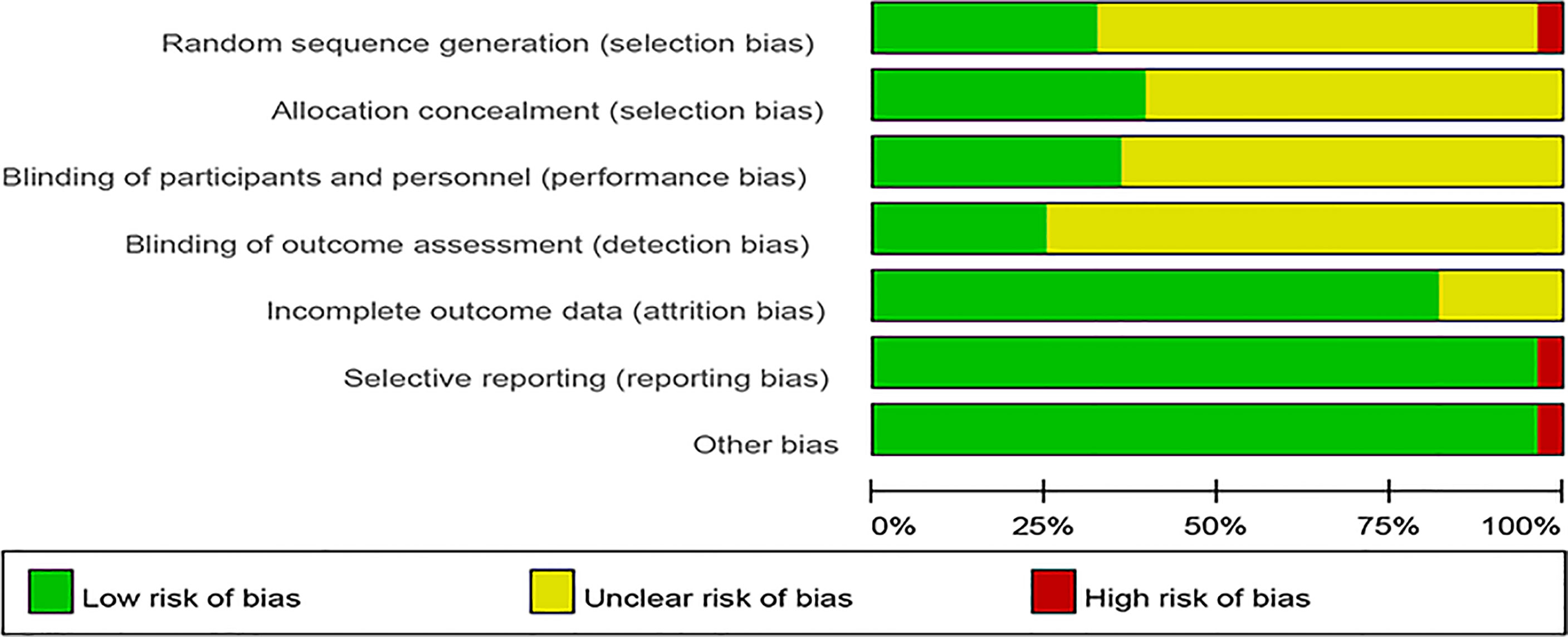
Evaluación del riesgo de sesgo. La evaluación del riesgo de sesgo se presenta en las Figuras 2 y 3. La mayoría de los estudios no mostraron de forma clara cómo generaron las secuencias aleatorias, ni establecieron de forma clara si se realizó la ofuscación de la asociación. En cuanto al método de enmascaramiento, la mayoría de los estudios tienen información insuficiente para permitir el juicio de “riesgo bajo” o “riesgo alto”. Se evaluaron tres ensayos con riesgo alto de sesgo por diferentes razones. Uno de los ensayos no reportó todos los indicadores de resultado primarios preespecificados. El método de asignación aleatoria en uno de los estudios fue incorrecto (los pacientes se asignaron al azar según la fecha de nacimiento). Dado que Nagata reportó que todos los participantes eran estudiantes femeninas universitarias de la misma universidad en el ensayo, se marcó como de “riesgo alto” en otros sesgos.
Análisis generales
Puntuación de los síntomas de la rinitis alérgica
La puntuación de los síntomas de RA incluyó la puntuación total de los síntomas de la rinoconjuntivitis (RTSS) y la puntuación total de los síntomas nasales (TNSS). La RTSS incluye cinco síntomas individuales de RA (congestión nasal, estornudos, rinorrea, prurito nasal y picazón en los ojos) clasificados de 0 (ningún síntoma) a 3 (síntoma grave). La TNSS se expresó como la suma de las puntuaciones de los cuatro síntomas (congestión nasal, rinorrea, prurito nasal y estornudos) anotados de 0 (ningún síntoma) a 3 (síntoma grave). Siete ensayos informaron datos previos y posteriores al tratamiento de la puntuación de los síntomas de RA disponibles para el metaanálisis. En comparación con el placebo, los probióticos mejoraron de forma significativa la puntuación de los síntomas de RA (DME, -0.29, IC de 95 % [-0.44, -0.13]). Hubo heterogeneidad alta en el resultado (p = 0.0003, I2 = 89%) (Figura 4). El análisis de sensibilidad indica que el resultado es sólido (Material complementario 13). Debido a la heterogeneidad estadística significativa encontrada en el análisis, se realizaron varios análisis de subgrupos por separado según la clasificación de RA, la combinación de fármacos y la intervención del grupo de tratamiento.
Con respecto a la clasificación de RA, los probióticos pueden aliviar de forma significativa los síntomas en pacientes con RAE (DME, -0.56, IC de 95 % [-0.87, -0.25]; p = 0.0003, I2 = 0 %), y hubo un beneficio significativo de que la suplementación con probióticos alivió la puntuación de síntomas de RAP (DME, -0.19, IC de 95 % [-0.37, -0.01]; p = 0.03, I2 = 94 %) (Material complementario 1). El análisis de subgrupos según la combinación de fármacos volvió a encontrar alguna evidencia de un efecto protector de los probióticos (monoterapia) en el alivio de los síntomas de RA en comparación con el placebo (DME, -0.73, IC de 95 % [-1.05, -0.42]; p < 0.00001, I2 = 93%). En comparación con los antihistamínicos, los probióticos combinados con antihistamínicos (terapia combinada) no tienen un alivio significativo de los síntomas de RA (DME, -0.15, IC de 95 % [-0.32, 0.03]; p = 0.10, I2 = 61 %) (Material complementario 2). Los resultados del análisis de subgrupos mostraron que los probióticos (solos) en comparación con el placebo no pueden aliviar de forma significativa los síntomas (DME, -0.49, IC de 95 % [-1.05, 0.07], p = 0.09). De manera similar, los probióticos combinados con antihistamínicos en comparación con los antihistamínicos no tienen un alivio significativo de los síntomas de RA (DME, -0.15, IC de 95 % [-0.32, 0.03], p = 0.10, I2 = 61 %). Los probióticos (mixtos) en comparación con el placebo tienen un alivio significativo de los síntomas de RA (DME, -0.85, IC de 95 % [-1.23, -0.46], p < 0.0001, I2 = 97 %) (Material complementario 3) (Tabla 2).
Puntaje del Cuestionario de Calidad de Vida de Rinoconjuntivitis
Siete ensayos informaron datos previos y posteriores al tratamiento de las puntuaciones del Cuestionario de Calidad de Vida de Rinoconjuntivitis (RQLQ) disponibles para el metaanálisis. Los resultados combinados con el modelo de efectos fijos mostraron una disminución significativa en las puntuaciones del RQLQ en el grupo de probióticos en comparación con el grupo de control (-0.64, IC de 95 % [-0.79, -0.49], p < 0.00001, I2 = 97 %) (Figura 5). El análisis de sensibilidad indica que el resultado es estable (Material complementario 13).
El análisis de subgrupos según la clasificación de RA encontró alguna evidencia de una disminución significativa en las puntuaciones RQLQ para la RAE en el grupo de probióticos en comparación con el grupo de control (DME, -0.32, IC de 95 % [-0.49, -0.15], p = 0.0002, I2 = 96 %), y mayor efecto beneficioso en la RAP (DME, -2.10, IC 95 % [-2.45, -1.74], p < 0.00001, I2 = 97 %) (Material complementario 4). El análisis de subgrupos según la combinación de fármacos volvió a encontrar alguna evidencia de un efecto protector de los probióticos (monoterapia) en el alivio de los síntomas de la RA en comparación con el placebo (DME, -1.74, IC de 95 % [-2.03, -1.46]; p < 0.00001, I2 = 97%). En comparación con los antihistamínicos, los probióticos combinados con antihistamínicos (terapia combinada) tienen un alivio significativo de los síntomas de RA (DME, -0.21, IC de 95 % [-0.39, -0.03]; p = 0.02, I2 = 0 %) (Material complementario 5). Los resultados del análisis de subgrupos mostraron que los probióticos (solos) en comparación con el placebo pueden aliviar de forma significativa los síntomas (DME, -3.81, IC de 95% [-4.29, -3.32], p < 0.00001, I2 = 0%). De manera similar, los probióticos combinados con antihistamínicos (terapia combinada) en comparación con los antihistamínicos mostraron una mejora significativa en las puntuaciones de RQLQ (DME, -0.21, IC de 95 % [-0.39, -0.03], p = 0.02, I2 = 0 %) (Material complementario 6) (Tabla 2).
Parámetros inmunológicos
IgE totales
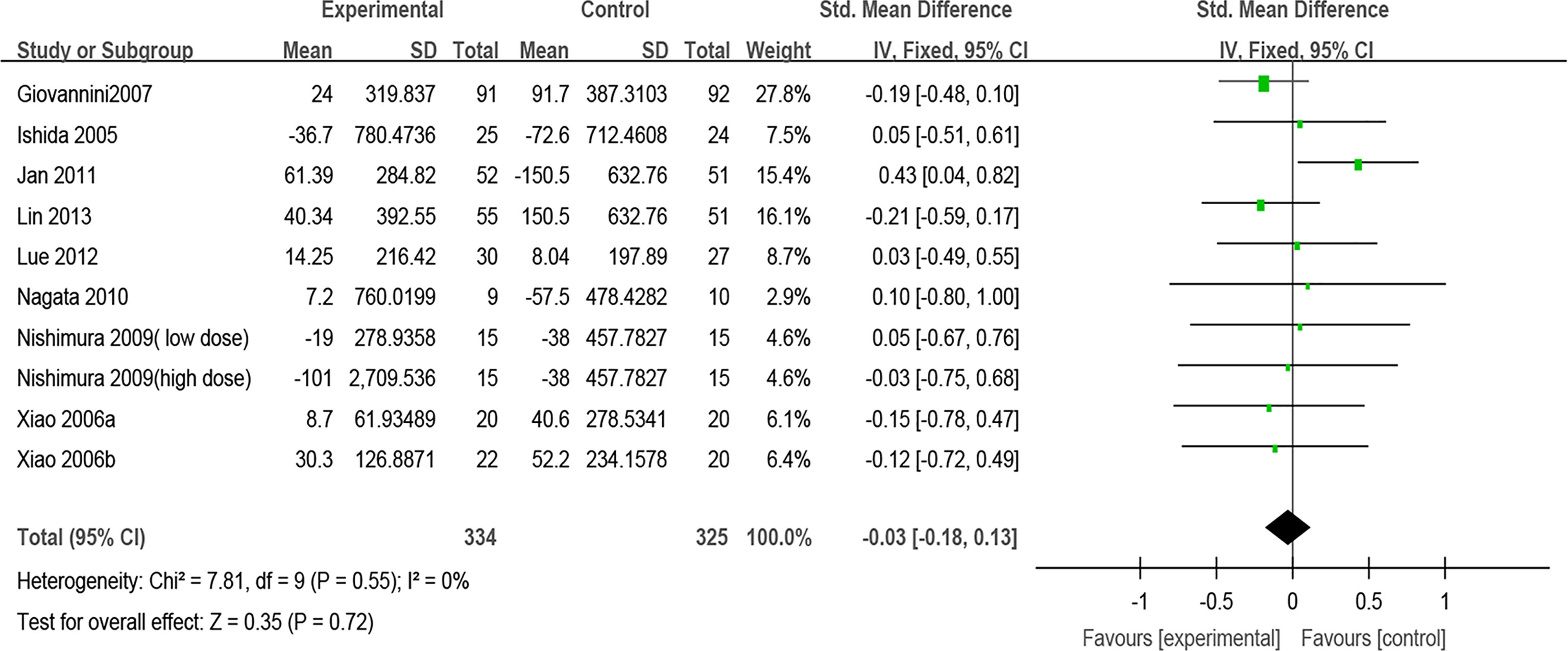
Nueve ensayos informaron el efecto de los probióticos sobre la IgE total. Después de agrupar nueve estimaciones, no se encontraron diferencias en la IgE total entre el grupo de probióticos y el grupo de control (DME, -0.03, IC de 95 % [-0.18, 0.13], p = 0.72, I2 = 0 %) (Figura 6). El análisis de sensibilidad indica que el resultado es estable (Material complementario 13). Se realizaron análisis de subgrupos según la clasificación de RA y la combinación de fármacos. Los resultados del análisis de subgrupos mostraron que el efecto de los probióticos en la IgE total pudo no afectarse por la clasificación de RA (RAP o RAE) o combinado con otros fármacos (Materiales complementarios 7 y 8) (Tabla 2).
IgE específica
La IgE específica se evaluó en seis estudios. Después de agrupar seis estimaciones, no se encontraron diferencias en la sIgE entre el grupo de probióticos y el grupo de control (DME, 0.09, IC de 95 % [-0.16, 0.34], p = 0.49, I2 = 0 %) (Figura 7). El análisis de sensibilidad indica que el resultado es estable (Material complementario 13). Se realizaron análisis de subgrupos según la clasificación de RA y la combinación de fármacos. Los resultados del análisis de subgrupos mostraron que el efecto de los probióticos en sIgE no podía verse afectado por la clasificación de RA (RAP o RAE) o combinado con otros fármacos (Materiales complementarios 9 y 10) (Tabla 2).
Relación Th1/Th2
Cuatro ensayos informaron suficientes datos para permitir el metaanálisis de la relación Th1/Th2. Los resultados mostraron que la relación Th1/Th2 fue menor en el grupo de control donde se agruparon las estimaciones del efecto de cuatro ensayos (DM, -2.47, IC de 95 % [-3.27, -1.68], p < 0.00001, I2 = 72 %) (Figura 8). El análisis de sensibilidad indica que el resultado es estable (Material complementario 13). Los análisis de subgrupos se realizaron de acuerdo con la clasificación de RA. Los resultados del análisis de subgrupos mostraron que el efecto de los probióticos en la relación Th1/Th2 pudo no afectarse por la clasificación de RA (RAP o RAE) o el plan de tratamiento (monoterapia/combinado) (Materiales complementarios 11 y 12) (Tabla 2).
Eventos adversos
De los veintiocho estudios incluidos, diecisiete ECA mencionaron que no se encontraron eventos adversos evidentes durante la investigación, mientras que siete ECA no mencionaron si ocurrieron eventos adversos. Cuatro ECA informaron eventos adversos que incluían diarrea, dolor abdominal, flatulencia y episodios de fiebre. Un estudio reportó que se observaron heces blandas y diarrea en los grupos activo y placebo, que no tuvieron diferencias significativas en los eventos adversos entre los dos grupos (prueba de chi cuadrada, p < 0.4). Otro estudio mostró que los sujetos con estas reacciones adversas a los medicamentos (diarrea, dolor abdominal y flatulencia) se recuperaron en unos pocos días. En este estudio, se encontró que la reacción adversa de un sujeto casi con seguridad se relacionaba con el medicamento. Un estudio reportó dolor abdominal leve en grupos de probióticos y todos los eventos adversos se aliviaron de forma espontánea sin tratamiento farmacológico. Un estudio reveló que los síntomas abdominales (síntomas abdominales, diarrea y episodios de fiebre) se informaron en 56.5 % frente a 64.2 % de los niños en los grupos de intervención y control (p = 0.282).
Evaluación de la calidad de la evidencia GRADE
La calidad de la evidencia aplicada para cada resultado se resume en la Tabla 3. La calidad de la evidencia en la puntuación de los síntomas de la rinitis alérgica, la Puntuación del Cuestionario de Calidad de Vida De la Rinoconjuntivitis, la IgE total, la IgE específica a antígeno y la relación Th1/Th2 se calificó como muy baja, muy baja, baja, baja y muy baja (Cuadro 3).
DISCUSIÓN
En este estudio, la evidencia clínica de los probióticos en el tratamiento de la RA se cotejó y analizó de forma sistemática para proporcionar una mejor orientación para la práctica clínica. Los resultados mostraron que la suplementación con probióticos para pacientes con RA puede mejorar los síntomas de RA y mejorar la calidad de vida. La suplementación con probióticos puede corregir el equilibrio Th1/Th2. No hubo cambios significativos en los niveles de IgE general o específica a antígeno entre los sujetos tratados con probióticos y los tratados con placebo. Los resultados de este estudio tienen una heterogeneidad significativa, y la fuente de heterogeneidad se exploró mediante análisis de subgrupos. Los resultados del análisis de subgrupos mostraron que los probióticos pueden aliviar de forma significativa los síntomas de RA en pacientes con RAE. El análisis de subgrupos según la combinación de fármacos encontró alguna evidencia de un efecto protector de los probióticos (monoterapia) en el alivio de los síntomas de la RA en comparación con el placebo. En comparación con los antihistamínicos, los probióticos combinados con antihistamínicos (terapia combinada) no tienen un alivio significativo de los síntomas de RA. Los análisis de subgrupos de estos resultados no lograron encontrar el origen de la heterogeneidad. Las diferentes dosis, duraciones y cepas de probióticos pueden ser fuentes de heterogeneidad. Con respecto a la puntuación de RQLQ, los resultados del análisis de subgrupos según la combinación de fármacos mostraron que los probióticos (cepa probiótica única) en comparación con el placebo pueden mejorar de forma significativa la calidad de vida. Del mismo modo, los probióticos combinados con antihistamínicos (terapia combinada) en comparación con los antihistamínicos mostraron una disminución significativa en las puntuaciones de RQLQ, lo que significa una mejora en la calidad de vida. Como se sabe, las células T auxiliares desempeñan un papel clave en la respuesta inmunitaria adaptativa. Las células T auxiliares humanas se pueden dividir en dos subtipos principales, Th1 y Th2. La tendencia significativa de la respuesta inmune al linaje Th2 puede conducir a enfermedades alérgicas. La inflamación alérgica mediada por inmunoglobina E (IgE) es el principal mecanismo fisiopatológico de la RA e impulsa reacciones inmunitarias polarizadas de células T auxiliares 2 (Th2).
El balance Th1/Th2 se asocia a RA. Th2 induce la activación de las células B y el cambio de clase de IgE, lo que conduce a la diferenciación de las células B en células plasmáticas que producen IgE específica a alérgenos. La IgE entra en la circulación y se une por medio de su dominio Cϵ3 al receptor de IgE de alta afinidad (FcϵRI) en la superficie de las células cebadas y los basófilos. Las células cebadas y basófilos activados liberan mediadores inflamatorios (por ejemplo, histamina y leucotrienos) que causan síntomas como picazón nasal, estornudos y secreción nasal. Al mismo tiempo, estos mediadores inflamatorios dan lugar a un predominio de las respuestas inmunitarias Th2, lo que exacerba aún más la inflamación. Por lo tanto, el predominio de Th2 y sus citocinas relacionadas se correlaciona con la gravedad de la RA. La relación Th1/Th2 puede reflejar el efecto de mejorar los síntomas de alergia por medio de medicamentos hasta cierto punto.
Este metaanálisis demostró que la suplementación con probióticos puede corregir el equilibrio Th1/Th2, lo que indica que la suplementación con probióticos puede mejorar la RA al regular el equilibrio Th1/Th2. Sin embargo, sólo cuatro de los estudios incluidos reportaron la relación Th1/Th2.
El propósito de la mayoría de las revisiones sistemáticas o metaanálisis es explorar el efecto preventivo de la suplementación con probióticos en las enfermedades alérgicas. Hay menos revisiones sistemáticas o metaanálisis para explorar el efecto terapéutico de los probióticos en RA. Una revisión sistemática y un metaanálisis de los probióticos en el tratamiento de la RA publicados en 2015 demostraron que los probióticos pueden ser beneficiosos para mejorar los síntomas y la calidad de vida de los pacientes con RA. Un metaanálisis mostró que los probióticos tienen efectos beneficiosos en el tratamiento de RA, en especial con RAE y la cepa LP-33. Sin embargo, las revisiones sistemáticas anteriores no exploraron las causas de la heterogeneidad tanto como fue posible. En comparación con revisiones sistemáticas y metaanálisis anteriores, este metaanálisis realizó un análisis de subgrupos según los tipos de RA (RAP/RAE) y el plan de tratamiento (cepa probiótica única/cepas probióticas mixtas/probióticos combinados con antihistamínicos; monoterapia/combinada). Se encontró que una sola cepa probiótica (LP-33) puede mejorar de forma significativa la calidad de vida de los pacientes con RA a partir del metaanálisis de tres estudios. Dos estudios utilizaron cepas probióticas mixtas. Un estudio demostró que una mezcla de bifidobacterias (B. longum BB536, B. infantis M-63 y B. breve M-16 V) pudo mejorar de forma significativa los síntomas de RA y la calidad de vida en niños con RA inducida por polen y asma intermitente. Otro estudio mostró que el probiótico NVP 1703 (una mezcla de B. longum y L. plantarum) alivia los síntomas de RA al incitar a las células Treg a liberar IL-10. Sin embargo, hubo una gran heterogeneidad a partir del metaanálisis de dos estudios, lo que puede relacionarse con el uso de diferentes probióticos. Las diferentes cepas de probióticos, dosis y duraciones pueden ser las fuentes de heterogeneidad. Hasta la fecha, no se observaron eventos adversos graves para el tratamiento con probióticos; por lo tanto, parece ser seguro.
En resumen, los suplementos de probióticos parecen ser efectivos para aliviar los síntomas de la RA y mejorar la calidad de vida, pero existe una gran heterogeneidad en algunos resultados después del análisis de subgrupos, y los médicos deben ser cautelosos al recomendar probióticos para tratar la RA.
Hay algunas limitaciones en este metaanálisis. Primero, el tamaño de la muestra de algunos ECA incluidos fue pequeño. En segundo lugar, las concentraciones de polen en el aire se asocian con la gravedad de los síntomas y la recuperación en pacientes con RAE. Las concentraciones de polen variaron debido a las diferentes regiones en diferentes ensayos. Ésta es una fuente de heterogeneidad clínica.
CONCLUSIÓN
Este estudio encontró que, a pesar de los resultados positivos de algunos resultados, existe evidencia débil de que los probióticos tienen un beneficio potencial en el tratamiento de la RA. También se necesitan más ECA que usen cepas probióticas específicas y medidas consistentes de resultado en el futuro para investigar la eficacia y la seguridad.
Luo C, Peng S, Li M, Ao X, Liu Z. The Efficacy and Safety of Probiotics for Allergic Rhinitis: A Systematic Review and Meta-Analysis. Front Immunol. 2022 May 19;13:848279. doi: 10.3389/fimmu.2022.848279.
Centro Regional de Alergia e Inmunología Clínica CRAIC
Hospital Universitario “Dr. José Eleuterio González” UANL
Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Med. Carmen Zarate Hernández Profesor
Dra. Gladis Abigail García García Residente Primer Año
Dra. Alejandra Macías Weinmann Profesor





No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.