1. Introducción
Los trastornos que afectan a la articulación se pueden dividir en dos grupos centrales. Las artritis autoinmunes inflamatorias primarias consisten en artritis reumatoide (AR) y espondiloartritis, que incluye a la artritis psoriásica (APs) y espondilitis anquilosante. Los hallazgos en la artritis inflamatoria a menudo se comparan con los de la osteoartritis no autoinmune (OA). La OA suele ser inducida por lesión articular previa, el estrés biomecánico en las articulaciones se debe a una mala posición o sobrepeso y obesidad. Las enfermedades metabólicas, como la diabetes o la hiperlipidemia, se consideran factores de riesgo clave para el desarrollo de OA. Aunque la degradación del cartílago es una característica central de la OA, que resulta en una respuesta inflamatoria que se debe al daño articular mecánico, toda la articulación se afecta, incluso el hueso adyacente, lo que implica la formación de osteofitos.
Por el contrario, la AR es un trastorno autoinmunitario caracterizado por una inflamación crónica grave temprana dentro de la enfermedad, lo que lleva a un daño articular irreversible si no se trata. La AR afecta principalmente a las articulaciones periféricas de forma simétrica, y provoca un daño articular progresivo. La presentación clínica de la AR varía, y los factores ambientales y los mecanismos epigenéticos se asocian con este trastorno. Una infiltración inflamatoria persistente del tejido sinovial contribuye a la activación local de las células sinoviales, lo que provoca la liberación de factores proinflamatorios y de degradación de la matriz en el tejido y el espacio articular. Los fibroblastos sinoviales de la AR (FSAR) exhiben una activación de fenotipo autónomo que contribuye al medio inflamatorio, así como a la hiperplasia sinovial.La APs y la AR son ambas enfermedades inflamatorias reumáticas crónicas que comparten similitudes como la sinovitis, pero también diferencias en la fisiopatología. Esto incluye un patrón vascular diferente en las articulaciones afectadas, una hiperplasia sinovial menos pronunciada en la APs en comparación con los pacientes con AR, y la célula que infiltra el complejo sinovial- enteseal inflamado es más prominente en los pacientes con APs. Por tanto, la entesitis es una de las características frecuentes de la APs según los Criterios de Clasificación de la Artritis Psoriásica (CASPAR) pero poco frecuentes en el caso de la AR y la OA. Los pacientes con APs también responden de manera diferente al tratamiento. Por ejemplo, el biológico anti-IL17A secukinumab es más eficaz en la APs que en los pacientes con AR.
La desregulación de los circuitos inmunoendocrinos se involucra en el desarrollo de trastornos metabólicos crónicos, como la obesidad, el síndrome metabólico y la diabetes, pero también desempeña un papel importante en las enfermedades inflamatorias crónicas, como la AR. Comprender los mecanismos, tanto de la regulación inmunológica como la resolución de la inflamación, son cruciales para el desarrollo de enfoques exitosos de tratamiento para lograr y mantener la remisión o la actividad baja de la enfermedad en la AR y la APs. Los mecanismos reguladores incluyen mediadores como citocinas, quimiocinas, hormonas, neurotransmisores y sus receptores del tejido inflamado, pero también de la periferia, que incluye el tejido adiposo. Muchas enfermedades se basan en la inflamación crónica durante años o durante toda la vida del paciente si no se tratan. Debido a alteraciones de los tejidos o componentes tisulares en el curso de la enfermedad, así como de manera específica debido a respuestas autoinmunes, el organismo ya no es capaz de terminar la fisiopatología del círculo inflamatorio, que da como resultado un daño continuo de los tejidos y, por último, la pérdida de la función y el deterioro de la calidad de vida.
2. Tejido adiposo y adipocinas
El tejido adiposo es el tejido clave que regula la homeostasis energética. También sirve como órgano endocrino debido a la secreción de una gran cantidad de sustancias bioactivas. Los factores que se liberan por el tejido adiposo se denominan adipocitocinas. Este grupo de mediadores incluye adipocinas, citocinas, quimiocinas, factores del complemento y hormonas. Las citocinas producidas por un exceso de tejido adiposo pueden afectar a todo el cuerpo, y provocar el desarrollo de la llamada inflamación de nivel bajo, que se puede observar en individuos obesos.
Las adipocinas son factores que se producen principalmente por los adipocitos en el tejido adiposo blanco. El tejido adiposo secreta una gran cantidad de factores activos de manera biológica. Sin embargo, muchas adipocinas, como la leptina y la adiponectina, también se conocen como moduladores de respuestas inmunes. Se identificaron alteraciones sistémicas de las adipocinas para un gran número de enfermedades inflamatorias crónicas, y se discute el potencial de las adipocinas como la adiponectina y la leptina. Por lo tanto, las adipocinas se investigan desde hace años en el contexto de enfermedades reumáticas crónicas inflamatorias y degenerativas de manera sistémica, así como a nivel local en células y tejidos. Además, se identificaron propiedades pro y antiinflamatorias de las adipocinas. Por lo tanto, se aceptó en el pasado que las adipocinas desempeñan un papel importante en la enfermedad reumática inmunomediada y la OA degenerativa.
2.1. Adiponectina
La adiponectina, codificada por el gen ADIPOQ, se describe principalmente como una adipocina antiinflamatoria. La adiponectina se produce en grandes cantidades por los adipocitos del tejido adiposo blanco. Las concentraciones de adiponectina se correlacionan de manera inversa con el índice de masa corporal (IMC). La adiponectina es una molécula compleja. Los monómeros de adiponectina forman diferentes isoformas, que dependen del grado de oligomerización: el trímero (peso molecular bajo [PMB]), el hexámero (peso molecular medio [PMM]) y la adiponectina multimérica (peso molecular alto [PMA]) que consta de 12-18 monómeros. La adiponectina globular, que consiste en el dominio de cabeza monomérico, se forma por escisión proteolítica. El monómero se presenta como intermediario en los adipocitos, mientras que en la circulación las formas principales son las isoformas de adiponectina multiméricas. Además de los dos principales receptores de adiponectina, AdipoR1 y AdipoR2, que pueden unirse a la adiponectina globular y a isoformas de longitud completa con diferentes afinidades, se describen otros receptores como T-caderina y PAQR3 (progestina y miembro de la familia de receptores AdipoQ 3). De manera reciente, Tanaka et al demostraron que la sobreexpresión de adiponectina aumentaba la regeneración de las miofibras que promueven la regeneración muscular de una manera dependiente de T-caderina. La adiponectina tiene varias funciones biológicas centrales, como la biosíntesis de ácidos grasos y la inhibición de la gluconeogénesis en el hígado. Sin embargo, la adiponectina no sólo muestra potencial como biomarcador debido a las alteraciones sistémicas bajo una condición inflamatoria, que se encontraron que disminuyen o aumentan en condiciones fisiológica y fisiopatológicas, pero también se involucra de manera activa en respuestas inflamatorias y afecta a diferentes tipos de células. En la diabetes tipo 2, la aterosclerosis y el síndrome metabólico, se describen efectos antiinflamatorios de manera predominante. Sin embargo, en el contexto de la artritis reumatoide, el papel de la adiponectina no se comprende por completo. A nivel celular y tisular, se describen efectos opuestos para enfermedades reumáticas, como en la AR, donde parece promover la inflamación y el daño tisular en las articulaciones afectadas. Los hallazgos recientes se detallarán en las secciones siguientes.
2.2. Leptina
La principal adipocina producida por los adipocitos es la leptina. Las concentraciones de leptina se correlacionan de manera positiva con masa de tejido adiposo blanco. Además, la leptina tiene funciones centrales en el metabolismo y también desempeña un papel en la inflamación y los trastornos inflamatorios. La leptina se codifica por el gen LEP (ob) y es una proteína no glicosilada de 16 kDa. Los efectos de la leptina están mediados por la unión a la forma larga del receptor de leptina LEPR. Por inducir factores anorexigénicos, se sabe que la leptina es una proteína central en la regulación del apetito y la obesidad. Sin embargo, la leptina también participa en muchos procesos además de la secreción de insulina y el metabolismo basal, como la reproducción, la regulación de la masa ósea y las enfermedades inflamatorias (crónicas). La leptina, a su vez, se induce en el tejido adiposo, que depende sobre el estado energético, por hormonas sexuales y por mediadores inflamatorios. A diferencia de la adiponectina, la leptina se considera una adipocina proinflamatoria. Se involucra en inflamación de grado bajo debida al sobrepeso en la obesidad. Las respuestas inmunes tanto innatas como adaptativas se afectan por la leptina, y el LEPR se expresa en la superficie de la mayoría células inmunes. La leptina aumenta la fagocitosis de los macrófagos, induce la proliferación de monocitos y macrófagos, altera la citotoxicidad de las células asesinas naturales, así como la proliferación de células T CD4, suprime las células T auxiliares tipo 2 (Th2) y aumenta las respuestas Th1, así como las respuestas de células T reguladoras (Treg). La leptina en sí se induce por citocinas proinflamatorias durante la infección aguda y la sepsis, pero también se induce durante enfermedades autoinmunes inflamatorias crónicas.
2.3. Visfatina
La visfatina, o el factor potenciador de colonias de células pre-B (PBEF), es una proteína multifuncional que tiene la capacidad de promover la diferenciación de células B y posee actividad enzimática nicotinamida fosforribosiltransferasa (Nampt). Estos diferentes mecanismos de acción hacen a la visfatina una proteína muy interesante. Permanece por aclararse, si los niveles de visfatina local alterados se asocian con su interacción extracelular con las células o se debe a su actividad enzimática intracelular Nampt, que conduce a cambios en el contenido de dinucleótidos de nicotinamida y adenina. La visfatina se produce por el tejido adiposo y por otros tejidos, como el hígado, la médula ósea, y el músculo. Puede inducirse por factores proinflamatorios, quimiocinas, hipoxia y por la visfatina en sí, y a su vez la visfatina induce una respuesta proinflamatoria en muchos tipos de células y tejidos por sí mismos. Se desconoce el receptor de la superficie celular para visfatina, y varios estudios demuestran que los efectos de la visfatina se deben en parte a su actividad Nampt. Sin embargo, se reporta de una interacción con la transmisión de señal del factor de crecimiento similar a la insulina (IGF)-1. Aquí, se puede demostrar que la visfatina inhibe la función mediada por IGF-1 de forma independiente de la activación del receptor de IGF-1, lo que sugiere otro mecanismo de acción además de su actividad Nampt. De manera interesante, se observó de manera reciente que varios micro ARN (miARN) se involucran en los efectos mediados por visfatina de modo específico en el contexto de los condrocitos en la OA. La visfatina redujo de manera significativa la viabilidad e indujo apoptosis en los condrocitos en la OA, lo que involucra la vía NFKB, así como la disminución de miR-140 y miR-146a y aumento de la expresión de iR-let7e en este estudio.
2.4. Resistina
La resistina es una proteína homodimérica rica en cisteína que se produce principalmente por macrófagos en humanos, mientras que, en animales como los ratones, la fuente de resistina son los adipocitos residentes del tejido adiposo. Por lo tanto, los resultados de los estudios con animales a menudo no pueden traducirse de manera directa a la situación humana. La resistina humana se describió como una proteína proinflamatoria que promueve el reclutamiento y la activación de células inmunes debido a que se produce por macrófagos. Además, se reporta un papel en el contexto del desarrollo de, por ejemplo, la enfermedad de las arterias coronarias, la aterosclerosis, la diabetes tipo 2, así como la OA y la psoriasis, lo que muestra un efecto promotor de la inflamación. Sin embargo, también se describen efectos antiinflamatorios de la resistina a nivel celular y tisular. Por lo tanto, el efecto de la resistina puede depender del tejido y la condición fisiopatológica estudiada. De manera adicional, se describe un papel inmunomodulador en el contexto de las enfermedades reumáticas, que incluyen AR, APs y OA.
2.5. Quemerina, vaspina y omentina
Los precursores de la quemerina consisten en una secuencia peptídica de señal hidrofóbica, un dominio cisteína que contiene pliegues y un dominio C lábil. La quemerina se activa después de la hidrolización por cisteína o proteasas serina. La eliminación de la secuencia de señal conduce a la secreción de una preforma con actividad biológica baja. Diferentes isoformas escindidas y mecanismos subyacentes de clivaje se describen en los últimos años, que están en el foco de investigaciones actuales. La quemerina se involucra en las respuestas inmunes y se describe su papel en el desarrollo de la ateroesclerosis coronaria y el síndrome metabólico, entre otras enfermedades. Se describen principalmente propiedades antiinflamatorias de las quemerinas para macrófagos, así como en un modelo de ratón con lesión pulmonar aguda inducida por LPS. A nivel celular, la quemerina actúa como quimioatrayente para las células asesinas naturales, macrófagos y células dendríticas.
La vaspina pertenece a una familia de inhibidores de las proteasas de la serina. La vaspina se asocia con la resistencia a la insulina y el síndrome metabólico, así como la aterosclerosis y la enfermedad cardiovascular. Además, del tejido adiposo subcutáneo, la vaspina también se expresa y se produce en otros tejidos como la piel y el músculo esquelético. De manera interesante, se describe que la vaspina está implicada en la inflamación del músculo esquelético. La sobreexpresión de vaspina en los ratones mostró un metabolismo alterado e inflamación con una mejor tolerancia a la glucosa y resistencia a la obesidad inducida por una dieta rica en grasas con niveles más bajos de IL-6 sistémica. A nivel celular, la vaspina altera la diferenciación de los adipocitos y la homeostasis de la glucosa. En el contexto de placas ateromatosas coronarias, el fenotipo proinflamatorio de los macrófagos se suprime por la vaspina. Sin embargo, está disponible conocimiento limitado sobre la evaluación del rol específico de la vaspina en el contexto de la autoinflamación en la AR.
La omentina es una glicoproteína que se une a los residuos de galactofuranosilo de los microorganismos y a la proteína de unión a lactoferrina. Se expresa principalmente en el tejido adiposo omental. Sin embargo, la omentina es abundante en el plasma de donantes sanos. Se describe que la omentina tiene principalmente efectos antiinflamatorios. Se describen efectos antiaterogénicos en individuos obesos, así como una asociación negativa con la enfermedad inflamatoria intestinal y el síndrome metabólico.
2.6. Progranulina, lipocalina-2 y nesfatina
La progranulina (PGRN, precursor de granulina/epitelina) consta de siete repeticiones de granulina/epitelina que pueden escindirse en pequeñas subunidades homólogas. La proteína de longitud total, así como los péptidos resultantes después de la escisión son activos de manera biológica. La PGRN es un factor autocrino que promueve diferentes procesos fisiológicos, como la diferenciación y la proliferación de los condrocitos, así como la osificación encondral. Se describen los efectos proinflamatorios y antiinflamatorios de PGRN. Las propiedades antiinflamatorias se median principalmente por la unión competitiva a los receptores del factor de necrosis tumoral (TNF) que altera las respuestas mediadas por el TNF-α. La PGRN se produce por muchas células diferentes, como los adipocitos, los macrófagos y los condrocitos, y se sugiere como un biomarcador potencial en enfermedades inflamatorias.
La nesfatina (nesfatina-1) es una adipocina involucrada en la inducción de la saciedad y en la homeostasis de la energía. Se secreta por el hipotálamo y actúa como factor anorexigénico. Además, se produce por tejido adiposo subcutáneo y otros tejidos dentro del intestino, páncreas y testículos. La lipocalina-2 (LCN2) es una adipocina inducida por factores proinflamatorios, como IL-1beta, LPS y otras citocinas, así como dexametasona y otras adipocinas, como leptina y adiponectina.
3. Adipocinas en la artritis reumatoide autoinmune
3.1. Artritis reumatoide
La AR afecta a 1% de la población en todo el mundo, y conduce a la pérdida de la función física de las articulaciones. Es una enfermedad autoinmune crónica sistémica que se desarrolla en individuos susceptibles de modo genético debido a factores ambientales y que involucra mecanismos epigenéticos. Al ser un trastorno muy heterogéneo con diferentes formas clínicas y mecanismos patogénicos dominantes, el tratamiento de la AR es un desafío. Con respecto a las enfermedades reumáticas, la AR fue la primera en evaluarse en el contexto de las adipocinas, y sus niveles sistémicos se compararon principalmente con aquellos en la osteoartritis degenerativa no inflamatoria y donantes sanos. Debido a la disponibilidad limitada de células y tejidos control de donantes sanos, los hallazgos a nivel celular por lo general se comparan con células de pacientes con OA.
Muchas células diferentes se involucran en la patogenia de las enfermedades articulares crónicas inflamatorias como la AR. La movilidad articular libre de fricción se asegura por la membrana y el líquido sinovial. La membrana sinovial consta de una capa delgada al borde del líquido de la membrana sinovial con dos tipos de células principales, las células sinoviales similares a macrófagos (llamadas tipo A) y sinoviocitos similares a fibroblastos (llamados tipo B). Ambos tipos de células también están presentes en la sublínea, que consiste principalmente en tejido conectivo y tejido adiposo en las capas más profundas. Los macrófagos sinoviales consisten en células residentes, pero también se originan de los monocitos en sangre. Los fibroblastos sinoviales producen ácido hialurónico y proteoglicanos, factores importantes del líquido sinovial. Además, están presentes poblaciones variables de leucocitos y vasos sanguíneos en el tejido sinovial. En las artritis inflamatorias crónicas como la AR y la APs, el tejido sinovial es el sitio central de la inflamación, lo que lleva a la hiperplasia sinovial y la activación local de las células sinoviales a lo largo del tiempo y, por último, resulta en daño cartilaginoso y óseo irreversible. La inflamación sinovial se caracteriza por una mayor permeabilidad de los vasos, lo que lleva a la infiltración de leucocitos. La proliferación local y la activación de FSAR es una característica típica y temprana de la AR y, junto con una mayor afluencia de monocitos, que se diferencian en macrófagos sinoviales de la AR, conduce a la formación una capa de revestimiento sinovial hiperplásica y un aumento de la densidad celular dentro del revestimiento. Debido a la interacción de los diferentes tipos de células y las cantidades altas de adipocinas presentes dentro del líquido y tejido sinovial, se realizan muchos esfuerzos para evaluar los efectos de las adipocinas en las diferentes células efectoras en la fisiopatología de la AR.
3.1.1. Adiponectina en la artritis reumatoide
Se demuestra un aumento de los niveles de adiponectina en el líquido sinovial de las articulaciones afectadas en la AR. Se describe que los niveles sistémicos de adiponectina aumentan en la AR, así como su asociación con la actividad de la enfermedad y la progresión de la enfermedad. Sin embargo, no todos los estudios confirman la correlación con la actividad de la enfermedad. Esto se debe de manera probable a los diferentes métodos de normalización, pero también a la heterogeneidad de la enfermedad. Sin embargo, la mayoría de los estudios demuestran una correlación de la adiponectina con marcadores inflamatorios como la proteína C reactiva (PCR), lo que incluye un estudio reciente que muestra que la adiponectina total y de PMA se correlaciona de manera positiva con los niveles de PCR. Una correlación positiva entre la adiponectina sérica y la puntuación de la actividad de la enfermedad (DAS) 28 - VSG en pacientes con AR se demostró en otro estudio transversal. De manera interesante, el tejido adiposo subcutáneo de los pacientes con AR produjo más adiponectina en comparación con los pacientes con OA y se correlacionó con la actividad de la enfermedad y la duración de la enfermedad en estos pacientes. Junto con esta línea, se describió de manera reciente un riesgo mayor para los sujetos obesos con niveles altos de adiponectina sérica basales para desarrollar AR, de manera específica con niveles altos de adiponectina y PCR, en un estudio durante un seguimiento de hasta 29 años. La respuesta al tratamiento anti-TNF-alfa parece asociarse con una mejoría en pacientes con niveles basales más altos de adiponectina. Otro estudio mostró un aumento de la adiponectina y una reducción de los niveles de quemerina en pacientes con AR después del tratamiento con anti-IL-6 tanto en monoterapia como en terapia combinada con metotrexato de manera independiente de la respuesta al tratamiento. Otro estudio reciente mostró que el tratamiento con tocilizumab de pacientes con AR activa a pesar de fármaco antirreumático modificador de la enfermedad sintético (FARME) y/o FARME biológico previo se asoció con un aumento en la adiponectina total y de PMA, en especial al comienzo del inicio del tratamiento, luego disminuye hasta el mes 6 al 12. En este estudio, el tratamiento anti-IL-6 también indujo una ganancia en la masa magra, mientras que la masa grasa se mantuvo sin cambios. El baricitinib, un inhibidor de JAK que bloquea las vías de transmisión de señales inflamatorias centrales, demostró de manera reciente disminuir los biomarcadores de inflamación sistémica, como IL-6, PCR, así como la adiponectina, en pacientes con artritis reumatoide.
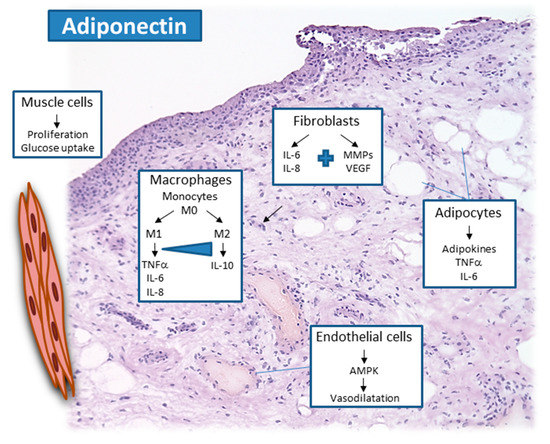
A nivel celular, numerosos estudios mostraron que los FSAR cultivados responden a la adiponectina por inducción de factores proinflamatorios, como la prostaglandina E2, la IL-6, la IL-8, así como metaloproteinasas de matriz como la MMP-1 y la MMP-13. De manera específica, las isoformas de adiponectina de PMA parecen mostrar efectos proinflamatorios más fuertes en FSAR. La estimulación con adiponectina de los FSAR afectó de manera indirecta a las células T cooperadoras foliculares, que fue mediada principalmente por la inducción de IL-6. La adiponectina de PMA indujo la producción de IL-6 en monocitos humanos no estimulados, pero no activados por LPS, mientras que la de PMB redujo la IL-6 y aumentó la IL-10 en monocitos activados por LPS. La adiponectina parece promover la diferenciación de células T vírgenes en células Th17, lo que contribuye a la inflamación sinovial y a las erosiones óseas, que pueden depender principalmente de AdipoR1, demostradas en modelos con eliminación condicional de AdipoR1. Otros tipos de células como condrocitos, células endoteliales, y linfocitos también mostraron una respuesta proinflamatoria a la adiponectina, lo que sugiere un efecto principalmente proinflamatorio de la adiponectina de manera local dentro de las articulaciones afectadas (Figura 1). Se demostró que la adiponectina puede aumentar la interacción de los FSAR con las células endoteliales—por ejemplo, un ensayo de unión de célula a célula.
Los fibroblastos son células centrales en la cicatrización de heridas que promueven la angiogénesis y el aumento de la angiogénesis es una característica destacada de la AR. Además, diferentes células óseas también responden a la adiponectina en la AR, pero esto también se demuestra para la OA. En los osteoblastos, la producción de citocinas proinflamatorias inducida por adiponectina, que se reduce al dirigirse a la adiponectina de PMM/ PMA en osteoblastos, pero que también mejora la artritis inducida por colágeno (AIC) en ratones, demuestra una contribución central de esas isoformas de adiponectina en los procesos inflamatorios en la AR. Por lo tanto, diferentes tipos de células responden a concentraciones alteradas de adiponectina local dentro de las articulaciones afectadas de pacientes con AR. Además de las células centrales del cartílago y de la erosión ósea, las células inflamatorias se alteran, muestran diferente reactividad a las diferentes isoformas de adiponectinas, que representan un enfoque interesante para atacar los efectos mediados por adiponectina.
3.1.2. Leptina en la artritis reumatoide
Se discute que el aumento de los niveles de leptina sistémica en la AR se relaciona con la progresión y la actividad de la enfermedad. Se demostró que las concentraciones sistémicas de leptina se correlacionan con el porcentaje de grasa corporal en pacientes con AR, y se reportó una asociación entre los niveles sistémicos de leptina e IL-6 con riesgo cardiovascular en pacientes con AR. En los FSAR y los FSOA, la leptina indujo la expresión de IL-6 e IL-8 que involucra a JAK2/STAT3 y otras vías de transmisión de señal. En ratones con deficiencia de leptina, se demostró una reducción de la gravedad de la artritis junto con los niveles de IL-1 beta y TNF-alfa. De manera interesante, se identificaron niveles elevados de leptina y vaspina sistémicas en la AR temprana comparado con controles sanos. Sin embargo, otro estudio mostró un aumento de los niveles de leptina en el síndrome metabólico, así como en pacientes con espondiloartritis, pero no en pacientes con AR después de un año de tratamiento con FARME y pudo observarse una disminución de la actividad de la enfermedad correlacionada con una disminución de los niveles de leptina en este estudio. Por el contrario, otro estudio se dirigió a pacientes con AR con una duración larga de la enfermedad (5 años), que demostró que los marcadores proinflamatorios, como el TNF-alfa, así como la resistina y leptina, fueron más altos en la AR de duración larga, aunque también aumentaron en la AR de duración corta (<1 año) en comparación con controles sanos. Por lo tanto, la duración de la enfermedad debe tenerse en cuenta al evaluar los niveles de leptina en la AR.
De manera interesante, se observó una asociación con niveles más altos de leptina sistémica en presencia de periodontitis y de forma específica en individuos con marcadores aumentados de periodontitis en pacientes con AR temprana. En cuanto a la respuesta al tratamiento, un efecto a corto plazo de tocilizumab con respecto a los niveles séricos de leptina en pacientes con AR en un estudio reciente mostró una reducción de la leptina después de la infusión de tocilizumab. En esta línea, se demostró que el tocilizumab, pero no el tratamiento con metotrexato aumenta el peso corporal, así como la relación leptina-adiponectina en pacientes con AR en un estudio retrospectivo de cohorte. Además, se reportó una asociación significativa de enfermedad cardiovascular en pacientes con AR, lo que sugiere que la leptina es un factor pronóstico confiable y un biomarcador para predecir complicaciones cardiovasculares en pacientes con AR. Una puntuación de actividad de la enfermedad con múltiples biomarcadores se utilizó en otro estudio reciente para evaluar su capacidad para predecir la remisión sostenida en RA, lo que demuestra que sus biomarcadores IL-6, amiloide A sérico (SAA), PCR y leptina pueden distinguir entre diferencias pequeñas en la actividad de la enfermedad y también son predictores de remisión de un año. La leptina representa una molécula con funciones complejas en el metabolismo. Sin embargo, debido a su asociación con comorbilidades y respuesta al tratamiento, su potencial como biomarcador para monitorear y comparar la respuesta al tratamiento en el contexto de enfermedades inflamatorias es de gran interés y se refleja en el número elevado de estudios que utilizan la leptina como parámetro de resultado.
3.1.3. Visfatina en la artritis reumatoide
Se demostraron respuestas proinflamatorias en FSAR, linfocitos, monocitos, condrocitos y células óseas para la visfatina en la AR por diferentes grupos en los últimos años. Los niveles de visfatina aumentan en la AR en comparación con los controles sanos y los pacientes con OA, y se demuestra una correlación entre visfatina sistémica y los marcadores inflamatorios como PCR y la actividad de la enfermedad. Por el contrario, la expresión de visfatina parece asociarse con un riesgo cardiometabólico adverso en la AR, que muestra un aumento de la expresión de MMP-2 con relación a la visfatina. Se discute el potencial de visfatina como diana terapéutica para la AR, ya que los inhibidores de visfatina de molécula pequeña están disponibles y ya se obtuvieron en oncología.
De manera interesante, la artritis inducida por colágeno (AIC) en ratones deficientes en visfatina mostró una reducción en la destrucción ósea, la progresión de la enfermedad y la actividad inflamatoria en estos animales. Además, este estudio reciente demostró que la visfatina es necesaria para la osteoclastogénesis y que este requisito se debe a su actividad Nampt. Esto está en línea con otro estudio que utilizó el APO866, un inhibidor que bloquea la actividad enzimática de Nampt, lo que conduce a una reducción de la gravedad de la AIC y la producción de factores inflamatorios. En cuanto a los FSAR, de manera reciente se demostró que la visfatina aumenta la adhesión de los FSAR a las células endoteliales en condiciones estáticas, así como las condiciones de flujo, lo que promueve de forma potencial la angiogénesis y la guía de vasos en la AR en el tejido sinovial. La visfatina es una de las adipocinas con potencial como biomarcador pero que también afecta a diferentes tipos de células en las articulaciones afectadas en la artritis. Aunque sigue sin estar claro el receptor de superficie celular de visfatina, la actividad enzimática de Nampt, que puede dirigirse al utilizar inhibidores específicos, hace que la visfatina sea una de las dianas de adipocinas más interesantes en las enfermedades reumáticas inflamatorias crónicas.
3.1.4. Resistina en la artritis reumatoide
Los niveles alterados de resistina sistémica en el contexto de la AR son controversiales. Sin embargo, un estudio reciente mostró niveles más altos de resistina en la AR de duración larga, pero los niveles de resistina también se elevaron en la AR de duración corta en comparación con los controles sanos. Por lo tanto, los niveles de resistina pueden depender de la duración y la gravedad de la AR. La resistina se expresa en el tejido y líquido sinoviales de pacientes con AR en comparación con OA. Los niveles elevados de resistina sinovial parecen correlacionar con la actividad de la enfermedad y los parámetros inflamatorios como los niveles de IL-6 y el recuento de leucocitos. Varios estudios reportaron niveles de resistina sistémica que correlacionan con biomarcadores inflamatorios como PCR, velocidad de sedimentación eritrocitaria (VSG) o TNF-alfa. Sin embargo, otros estudios no pudieron demostrar una correlación de la resistina del líquido sinovial con los niveles sistémicos de PCR o los niveles sistémicos de resistina con parámetros de inflamación. Por otro lado, la inyección intraarticular de resistina en un modelo de ratón indujo inflamación e hiperplasia en el tejido sinovial, similar a la artritis. A nivel local, las células del estroma, como los FSAR y los osteoblastos, y las células inmunitarias, como los macrófagos y las células B, expresan la resistina en las articulaciones afectadas en la AR. Las células inflamatorias como macrófagos humanos, leucocitos del líquido sinovial o células mononucleares de sangre periférica (CMSP) responden de manera proinflamatoria a la resistina y también lo hacen los FSAR, de forma específica con la liberación de factores proinflamatorios y quimiocinas. De manera interesante, la terapia anti-TNF alfa redujo de modo rápido los niveles séricos de resistina en pacientes con AR en estrecha asociación con la PCR. En esta línea, la expresión de resistina se redujo en las células T CD4 y monocitos CD14 en pacientes con AR que responden a la terapia anti-TNF alfa a diferencia de los pacientes que no respondieron al tratamiento. De manera reciente, se reportó que después del tratamiento con tocilizumab durante 24 semanas, los niveles de resistina aumentaron de manera significativa. Sin embargo, con respecto al tratamiento anti-IL-6 con tocilizumab de pacientes con AR activa a pesar de previos FARMEScs y/o FARMESb, se no observaron cambios significativos en la resistina sistémica junto con la leptina y la grelina durante el seguimiento después de 12 meses en contraste con la adiponectina. Además, se encontró que la resistina no se asoció con el síndrome metabólico (según el ATP III y los parámetros clínicos del Programa Nacional de Educación sobre el Colesterol) al inicio del estudio y después de un año de tratamiento de pacientes con AR y FARMES. Sin embargo, la disminución de la resistina se correlacionó con una disminución de la actividad de la enfermedad en estos pacientes. No está claro si el impacto de la actividad de la enfermedad puede ser más prominente en comparación al síndrome metabólico en este enfoque de tratamiento con FARME. En resumen, el papel de la resistina como biomarcador y su papel fisiopatológico en la respuesta al tratamiento de los pacientes con AR no se comprenden de manera completa y pueden depender del enfoque del tratamiento, el inicio de tratamiento durante el curso de la enfermedad, así como la dosis.
3.1.5. Quemerina, vaspina y omentina en la artritis reumatoide
Las isoformas de quemerina escindidas aumentan en el líquido sinovial en la AR y los niveles plasmáticos elevados de quemerina se correlacionan con el IMC y la actividad de la enfermedad en la AR. De manera reciente, se postuló que la visfatina y la quemerina se incrementan en pacientes con AR y la quemerina se puede utilizar como marcador de inflamación en pacientes con AR. De manera interesante, se encontró que la quemerina total aumenta en el suero de AR, aunque de forma reciente se reveló que, al utilizar un enfoque proteómico, están presentes principalmente las isoformas de quemerina 155A, 156F y 157S en el suero de AR, lo que es diferente de la distribución en el síndrome de ovario poliquístico, que también muestra aumento de los niveles totales de quemerina. Se observó una reducción de los niveles de quemerina después del tratamiento con tocilizumab, un inhibidor anti-IL-6, en pacientes con AR, lo que demuestra su potencial como biomarcador inflamatorio. A nivel local, los condrocitos y los FSAR también expresan quemerina como su receptor. La estimulación de FSAR y FSOA con quemerina indujo IL-6, quimiocinas y MMP-3 en estas células e IL-1 en los condrocitos. Además, la quemerina indujo la migración de FSAR y leucocitos.
Se describió que el aumento de los niveles de vaspina sistémica se asocian con la inflamación en la AR. En el líquido sinovial, los niveles de vaspina fueron más altos en la AR en comparación con la OA, pero no se observó correlación con los marcadores inflamatorios. Aunque el papel de la vaspina en la fisiopatología de las células de la AR es limitado, hay alguna evidencia de que la vaspina puede afectar a diferentes células en el desarrollo de la AR. Sin embargo, se describe que los osteoblastos humanos se protegen de la apoptosis por la vaspina, y se demostró que la vaspina inhibe la osteoclastogénesis y la actividad de los osteoclastos al utilizar una línea celular de macrófagos múridos RAW264.7. También se describió de manera reciente un aumento de los niveles de vaspina en pacientes con APs en comparación con controles sanos. En este estudio se demostró que los niveles de vaspina y la lipocalina asociada a gelatinasa de neutrófilos, así como las proporciones de apolipoproteína B1/A1 fueron mayores de manera significativa en la APs en comparación con los controles, pero ninguno de los factores se correlacionó con la actividad de la enfermedad. En la espondilitis anquilosante, se encontró que los niveles bajos de vaspina se relacionaron con disfunción endotelial, que muestra regulaciones y funciones similares en la artritis. Sin embargo, los estudios que evalúan el papel de la vaspina en el contexto de la reumatoide la artritis reumatoide son limitados.
Se encontró que la omentina es menor en el líquido sinovial en la AR en comparación con los pacientes con OA. Sin embargo, se describe una asociación de omentina sistémica con PCR para pacientes con AR. Por el contrario, no se observaron concentraciones elevadas de omentina en los tejidos de la AR en comparación con OA. Esto está en línea con un estudio que muestra una respuesta débil de ambos FSAR y FSOA a la estimulación de omentina, lo que sugiere sólo efectos débiles de omentina en la AR y en otras células efectoras en respuesta a omentina. Sin embargo, también se encontró omentina sérica elevada en la APs en comparación con los controles sanos.
La quemerina y la vaspina mostraron una correlación positiva con la inflamación y, en parte, enfermedad progresiva. Sin embargo, se requieren estudios adicionales para evaluar de manera completa el potencial de estas adipocinas como biomarcadores para la progresión de la enfermedad y la respuesta al tratamiento en la AR. Además, los efectos de estas adipocinas a nivel celular requieren evaluación adicional para estimar de forma completa su papel en la inflamación crónica y la contribución al cartílago y la destrucción ósea en la AR.
3.1.6. Progranulina, nesfatina y lipocalina-2 en la artritis reumatoide
Se encontró que los niveles de progranulina (PGRN) aumentan en el líquido sinovial y el suero de los pacientes con AR en comparación con los pacientes con OA y los donantes sanos. Se describe una correlación entre la PGRN sistémica y la actividad de la enfermedad y la progresión de la AR, por lo tanto, la PGRN puede representar un marcador prometedor para las respuestas inflamatorias en la AR. De manera interesante, se descubrió de manera reciente que la presencia de anticuerpos anti-PGRN en pacientes con AR se asocia con una mayor actividad de la enfermedad en comparación con los pacientes negativos para anti-PGRN. Además, la PGRN es un mediador importante en el mantenimiento de la integridad del cartílago. También se observó un efecto protector sobre la diferenciación de osteoblastos en condiciones inflamatorias. Sin embargo, el aumento de las concentraciones de PGRN observado en la AR puede no ser suficiente para inhibir los efectos proinflamatorios en condiciones autoinmunes crónicas. Esto está en línea con los hallazgos en modelos animales de artritis inflamatoria, que muestran que la expresión de PGRN promueve una enfermedad más grave, y la atsttrina, una proteína modificada compuesta por tres fragmentos de progranulina, demostró tener efectos similares a los de la progranulina con efectos beneficiosos en la artritis, pero de forma aparente también efectos antineuroinflamatorios. De manera interesante, los autoanticuerpos de progranulina fueron detectables de manera aproximada en 25% de los pacientes seropositivos con AR y en 21% de los pacientes con AR con factor reumatoide y anticuerpos antipéptido cíclico citrulinado (ACPA) negativos. Los valores medios de DAS28 fueron más altos de manera significativa en los pacientes con AR con autoanticuerpos positivos para progranulinA en este estudio.
Se encontró que la nesfatina se asoció de manera positiva con el factor reumatoide en pacientes con AR, correlacionado con las concentraciones de MMP-2 y redujo la aterosclerosis en estos pacientes. Sin embargo, no se encontró que la nesfatina-1 se asocie con el IMC o la actividad de la enfermedad en los pacientes con AR en un estudio reciente.
La lipocalina-2 se eleva en el líquido sinovial en la AR en comparación con los pacientes con OA, así como en el suero de pacientes con AR. La LCN2 se induce en los tejidos articulares debido a factores de carga mecánica e inflamatorios, pero también por adipocinas, como la leptina y la adiponectina en los condrocitos. El TNF alfa y la IL-17 pueden inducir LCN2 en osteoblastos y la LCN2 inducida en los neutrófilos por el factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) se asoció con la proliferación de células sinoviales y la infiltración celular en el tejido sinovial en la AR. En la espondilitis anquilosante, se encontraron 2 valores elevados de lipocalina, y en los ratones con mutación ank/ank, un modelo de ratón para espondilitis anquilosante, el aumento de los niveles de lipocalina-2 se asociaron con la coexistencia de anquilosis e inflamación intestinal observada en estos animales.
Se requieren estudios adicionales que evalúen las adipocinas como la lipocalina-2 y la nesfatina para dilucidar el potencial de estos factores como biomarcadores y proteínas inmunomoduladoras. Por el contrario, varios estudios que abordan el potencial de progranulina como un marcador en el contexto de la AR mostró una correlación clara con la actividad de la enfermedad en humanos, así como en modelos animales de artritis inflamatoria. Por lo tanto, la PGRN representa una adipocina interesante con potencial como biomarcador, así como proteína inmunomoduladora que afecta a diferentes tipos de células.
3.1.7. Red de adipocinas en la artritis reumatoide
Numerosos estudios evalúan varias adipocinas, lo que contribuye al conocimiento de la diafonía de las redes de adipocinas y las relaciones entre las adipocinas como mediadores moleculares en la AR. Tanto la quemerina sistémica como la visfatina aumentaron en la AR en comparación con los controles sanos con quemerina, lo que muestra la mayor especificidad para la AR. A nivel celular, tanto la visfatina como la resistina alteran la expresión del ARNmi en los condrocitos, lo que lleva a una viabilidad reducida y apoptosis aumentada, lo que demuestra el papel de estas adipocinas en la erosión del cartílago. En cuanto a la relación de la adiponectina y leptina, la leptina sérica y la adiponectina normalizada a la masa de grasa corporal fueron más altas de manera significativa en comparación con los controles sanos, y las concentraciones de adiponectina se correlacionaron de manera positiva con el grado de destrucción ósea y la MMP-3 sérica en contraste con la leptina, lo que sugiere una relación de la adiponectina con la erosión ósea y ambas adipocinas con inflamación. Sin embargo, otro estudio encontró que tanto los niveles sistémicos de leptina como de resistina se correlacionan con marcadores y actividad de AR de manera independiente del IMC de los sujetos en contraste con la adiponectina al comparar pacientes con actividad de la enfermedad baja, moderada y alta según DAS28. En pacientes con AR con enfermedad activa, el tratamiento con tocilizumab redujo de manera significativa la quemerina, mientras que el aumento de la adiponectina, y la leptina y la resistina no se alteró en este estudio. Sin embargo, otro estudio que aborda el tratamiento con tocilizumab en pacientes con AR encontró niveles de adiponectina más altos de manera significativa en la AR al inicio del estudio, mientras que posterior al tratamiento con tocilizumab, aumentaron los niveles de resistina y la relación leptina-adiponectina; en contraste, los niveles de adiponectina ajustados al IMC disminuyeron y los niveles de leptina se mantuvieron sin cambios. Estos estudios muestran que los ajustes de adipocinas deben tenerse en cuenta además de la actividad de la enfermedad para dilucidar de manera clara el papel de las adipocinas y las relaciones de las adipocinas de forma sistemática. Sin embargo, estos y muchos estudios anteriores muestran de manera clara que las adipocinas se alteran en el contexto de enfermedades inflamatorias crónicas y representan biomarcadores de inflamación, así como de la actividad de la enfermedad, erosión articular y respuesta al tratamiento.
3.1.8. Resumen y conclusiones
La inflamación crónica conduce a daño tisular, que, en el caso de las enfermedades crónicas inflamatorias de las articulaciones, da como resultado un daño irreversible del cartílago y el hueso. El dolor prolongado y la pérdida de la función locomotora tiene un impacto negativo en el sistema sanitario y social. En los últimos años, se demostró que los factores metabólicos, de manera específica, los factores que se producen en cantidades altas por el tejido adiposo y los adipocitos contribuyen a procesos inflamatorios no sólo en la AR, pero también en muchas otras enfermedades autoinmunes. Muchas enfermedades autoinmunes son muy heterogéneas, lo que lleva a la necesidad de diferentes opciones de tratamiento. Encontrar marcadores en común para permitir una identificación mejor y más temprana como nuevos biomarcadores y herramientas de diagnóstico, incluida la evaluación de la eficacia del tratamiento, sería de gran valor. Además, está bien establecido que no sólo los efectos protectores están mediados por las adipocinas, sino que también contribuyen a las respuestas inflamatorias de las células inmunitarias. Además, las células del tejido conectivo y las células óseas en la AR se alteran por adipocinas como la adiponectina y la visfatina. Las adipocinas son capaces de interactuar y en parte inducirse entre sí, y forman una compleja red de adipocinas. Debido a las funciones tanto antiinflamatorias y proinflamatorias de manera parcial de algunas adipocinas, es difícil evaluar una función específica en una enfermedad compleja y multifactorial como la AR. El interés elevado en la evaluación del papel de las adipocinas en la inflamación sinovial, así como en el cartílago y la erosión ósea, que conduce a la destrucción progresiva de las articulaciones afectadas, es visible en el número de estudios realizados en los últimos años, lo que contribuye al conocimiento sobre el rol de adipocinas en la autoinmunidad, así como de manera específica en la fisiopatología de la artritis crónica inflamatoria.
Adipokines and Autoimmunity in Inflammatory Arthritis
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Rosalaura Virginia Villarreal González Profesor
Dra. Ana Karen Chávez Ruíz Residente 1er Año
Dra. Alejandra Macías Weinmann Profesor


.jpg)



No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.