1. Introducción
El microbioma humano se refiere a la información genética colectiva de los microorganismos que habitan el cuerpo humano. Se considera una contraparte del genoma humano, que es la colección de toda la información genética en una persona.
Con el descubrimiento de que los microorganismos que llevamos tienen un enorme impacto en la salud, el microbioma se llama el “segundo genoma” y está en estudio de forma amplia. El microbioma participa en una serie de procesos biológicos humanos como el metabolismo, el desarrollo epitelial y la inmunidad. Enfermedades de larga data como la obesidad, las enfermedades inflamatorias intestinales, la diabetes mellitus, la rinitis alérgica y la dermatitis atópica (DA) se reportan vinculadas con el microbioma humano de manera no causal.
Los estudios que se realizan para identificar la dinámica de la población bacteriana utilizan principalmente un enfoque metagenómico que es fácil y barato de manera relativa. El uso de una secuenciación completa del metagenoma permite el acceso sin restricciones a los genes de toda la flora presente en una muestra. Como alternativa, se puede realizar la secuenciación de próxima generación (SPG), que analiza de manera simultánea miles de millones de amplicones del gen de ARN ribosómico 16S en bacterias y arqueas. El aumento del rendimiento y la disminución de los costos asociados con la secuenciación del ADN, junto con el desarrollo de herramientas de análisis, hicieron factibles estos enfoques para consultar comunidades microbianas en estados de salud y enfermedad. Es importante destacar que estos métodos no dependen del cultivo del microorganismo, lo que elimina los sesgos asociados con técnicas basadas en el cultivo.
La DA es una afección inflamatoria crónica de la piel con prurito prominente. La DA comienza en la primera infancia y suele ser la primera manifestación de la marcha atópica, que progresa a asma, rinitis y conjuntivitis alérgicas. La DA tiene una fisiopatología compleja que incluye una respuesta sesgada hacia la inmunidad Th2, y defectos en el sistema inmune innato. La aparición de la FLG como un alelo de riesgo para la enfermedad atópica también cambió el peso sobre el papel de la barrera cutánea en la patogénesis de la DA. La prevalencia de la DA está en aumento. Aunque la DA se presenta en familias, es imposible explicar la mayor prevalencia de DA con la genética sola. Los factores que predisponen a la DA pueden ser familias de tamaño más pequeño, entornos urbanos y dieta occidental, que afectan tanto a la piel como a la microbiota intestinal.
El microbioma tiene un papel bien documentado en la DA. La interacción crucial entre la flora y los humanos en la DA se presenta mejor mediante la hipótesis de la higiene. Esta teoría implica que, en las condiciones de vida sanitarias modernas, hay una exposición microbiana reducida al principio de la vida, lo que resulta en cebado inmunitario inadecuado. La microbiota temprana de un niño tiene influencia protectora en el sistema inmune de la sensibilización alérgica. Por el contrario, se sabe que el desarrollo pobre o el desequilibrio del microbioma afecta la respuesta inmune cutánea de una manera que los niños están predispuestos a un número de condiciones inmunes, como la DA, con infecciones secundarias frecuentes de la piel. La interacción entre el microbioma y el sistema inmune en pacientes con DA amplía el conocimiento sobre la patogénesis de la DA y cambia el concepto tradicional de la terapia con antibióticos. En esta revisión, se discuten los roles de la piel y la flora intestinal en el desarrollo, la manifestación y la atenuación de la DA.
2. Microbiota cutánea y DA
La piel es un refugio para innumerables comunidades microbianas que viven en el tejido superficial, así como los apéndices, como las glándulas sudoríparas y el folículo piloso. Entre la superficie de la piel, se encuentran 1 millón de bacterias por centímetro cuadrado con más de 1010 células bacterianas en total. Existe una diversidad topográfica de las poblaciones bacterianas en la piel, que depende del microambiente (temperatura, edad, cantidad de sebo, sudor, etc.) Los sitios sebáceos están llenos de especies lipofílicas de Cutibacterium (de forma previa Propionibacterium), mientras que Corynebacterium, amante de la humedad y las especies de Staphylococcus están presentes en grandes cantidades en áreas húmedas. El hongoMalassezia es abundante en el tronco y los brazos. La flora de la piel humana, posiblemente la más diversa dentro del cuerpo, se considera crucial en la defensa del anfitrión. La flora cutánea comensal protege a los humanos de los patógenos y ayuda a mantener el delicado equilibrio del sistema inmunitario entre una protección efectiva y los daños por inflamación. La flora comensal como el Staphylococcal epidermidis (S. epidermidis) produce sustancias antimicrobianas que luc contra los patógenos, mientras que Cuticabacterium acnes (C. acnes) utiliza los lípidos de la piel para producir ácidos grasos de cadena corta que amortiguan las amenazas microbianas. Cutibacterium y Corynebacterium también reducen al Staphylococcus aureus (S. aureus) al formar porfirina (hallazgos de estudios in vitro y en animales).
2.1. Microbiota cutánea en DA
Se reportó que la diversidad de la microbiota de la piel sana es mayor de manera prominente en la población más joven que en adultos (diversidad alfa, p = 0.01) y muy diferente entre los dos grupos de edad como lo muestra la diversidad beta. Mientras que grandes cantidades de Streptococcus, Rothia, Gemella, Granulicatella, y Haemophilus están presentes en niños pequeños; Cutibacterium, Lactobacillus, Anaerococcus, Finegoldia,yCorynebacterium fueron más comunes en adultos. También se observaron diferencias significativas en la microbiota cutánea entre niños con DA y adultos (diversidad beta, p < 0.001). Se encontró que los pacientes con DA portaban los 20 géneros que prevalecieron en la población sana. La prevalencia de DA entre los niños es 20 a 30 por ciento, mientras que la de los adultos es sólo 3%. El cambio microbiano puede contribuir de forma potencial a la reducción de la DA relacionada con la edad al suprimir el crecimiento de S. aureus. Los comensales cutáneos asociados a adultos Cutibacterium yCorynebacterium albergan genes implicados en el metabolismo de la porfirina que de forma teórica puede reducir la infección por S. aureus (hallazgos de estudios in vitro y en animales). De manera adicional, la flora cutánea adulta secreta metabolitos con propiedades antimicrobianas, que a su vez bloquean el crecimiento de S. aureus como se muestra en estudios in vitro y en ratones (Tabla 1).
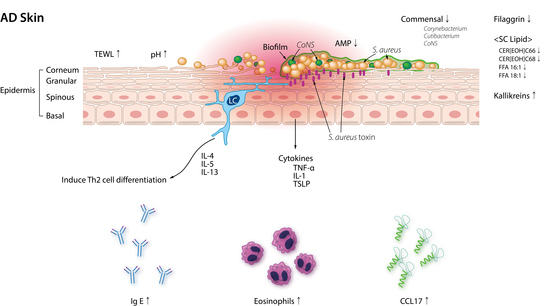
Se reporta que los pacientes con DA portan S. aureus en su piel a tasas que varían de 30 a 100%, mientras que S. aureus sólo se encuentra en 20% de las personas sanas. Según un metaanálisis, el transporte de S. aureus es diferente incluso dentro del mismo paciente con DA, y oscila entre 39% en piel no lesionada y 70% en piel lesional. Se sabe que la densidad de S. aureus se correlaciona con la gravedad de la enfermedad, de manera independiente del sitio (tanto piel lesionada y no lesionada) (causalidad no probada). Además de S. aureus, otros especies de Staphylococcus (S. epidermidis yS. haemolyticus) aumentan en los sitios afectados por la DA. La flora de la piel muestra diversidad microbiana baja durante un brote de DA de manera independiente de la edad. En particular, la piel inflamada de la DA se asocia a una disminución en los géneros Cutibacterium, Streptococcus, Acinetobacter, Corynebacterium, y Prevotella y un aumento de Staphylococcus, en especial, S. aureus (Tabla 2).
En un estudio, se encontró que la abundancia de C. acnes correlaciona de forma negativa con S. aureus donde el crecimiento de S. aureus yS. epidermidis se bloqueó por los productos de fermentación de C. acnes (confirmado por estudio de cultivo). La diversidad bacteriana también se relaciona de forma estrecha con la calidad de la barrera cutánea, retratada por la pérdida transepidérmica de agua (PTEA) y el nivel de pH en la DA canina. Con la ayuda de la secuenciación metagenómica, se encontró que los pacientes con DA portaban una sola cepa de S. aureus durante los brotes graves. De manera interesante, las cepas de S. aureus extraídas de pacientes con DA son diferentes de las de los portadores no afectados. Mientras que la mayoría de los pacientes con DA tienen las cepas del complejo clonal (CC1), las cepas CC30 son comunes entre los portadores nasales asintomáticos en la población normal. La flora de la piel se vuelve más diversa después del tratamiento de la DA.
El número de estudios exhaustivos sobre micobiota es menor de forma sustancial que el realizado sobre la microbiota bacteriana. Zhang E y colaboradores reportaron que entre las tres categorías taxonómicas de hongos (levadura diferente a Malassezia, Malassezia, y hongos filamentosos), las especies de Malassezia son las más notables en sujetos con DA, que representan 63-86% de los clones. La Malassezia restricta (M. restricta) y la Malassezia globosa (M. globosa) son los dos subtipos principales aislados dentro del género Malassezia. La relación de estas dos especies de Malassezia difiere según la gravedad de la DA. Los pacientes con DA con gravedad leve a moderada muestran predominio de M. restricta sobre M. globosa, mientras que la proporción se aproxima a 1 en pacientes con DA grave. En general, las levaduras diferentes a Malassezia(por ejemplo, Cryptococcus liquefaciens Candida albicans, Cryptococcus diffluens) en pacientes con DA fueron más diversas que las encontradas en la población sana.
2.2 El estado de la barrera epidérmica afecta la composición de la microbiota cutánea
La DA es una enfermedad inflamatoria cutánea de larga data caracterizada por disfunción de la barrera epidérmica que puede afectar a la comunidad bacteriana de la piel. El estrato córneo se forma por células muertas (ladrillo) y una matriz lipídica (mortero), que participan en la permeabilidad epidérmica. Los lípidos importantes del estrato córneo son los ácidos grasos libres (AGL), las ceramidas y el colesterol. Los AGL son cruciales para la barrera de la piel y sus longitudes de cadena son mucho más cortas en la piel con DA. El análisis integrado reveló una fuerte asociación entre el microbioma y la composición lipidómica donde la abundancia de Cutibacterium y Corynebacterium correlacionó de forma positiva con los niveles de AGL insaturados de cadena larga en la epidermis.
Los niveles de AGL 16:1 y AGL 18:1 también se encontraron de forma significativa más bajos en la población con DA positiva para S. aureus en comparación con pacientes con DA negativos para S. aureus. La AGL 16:1 exógena se reporta como potente inhibidor del crecimiento bacteriano (hallazgo in vitro), lo que sugiere que los AGL son responsables de la defensa antimicrobiana. La proporción de ceramida 1, que es un portador de linoleato que funciona como la barrera de agua de la piel, es baja en pacientes con DA.
El nivel de ceramida de cadena muy larga también disminuye por una gran cantidad en pacientes con DA positivos para S. aureus en comparación con la población con DA negativa para S. aureus y correlaciona de forma negativa con la PTEA.
La filagrina es un componente crucial de la barrera cutánea y su mutación por pérdida de función se relaciona con la DA, así como el asma. En pacientes con DA establecida, la deficiencia de filagrina, ya sea genética o derivada de condiciones dominantes Th2 se demostró que causa defectos en los corneocitos. Se descubrió que el S. aureus en la DA se une de manera fuerte a estos corneocitos de una manera dependiente del factor de agrupamiento B en un estudio ex vivo. La deficiencia de filagrina en la DA también se asocia con un pH más alto, una condición favorable al crecimiento de S. aureus (hallazgo de estudio in vitro). En pacientes con DA, la actividad de la serina proteasa (de manera específica las calicreínas) aumenta.
Se sabe que las calicreínas hiperactivas alteran el procesamiento de catelicidina y filagrina y aumentan la actividad de la proteasa activada por el receptor 2 (PAR-2) (estudios in vitro y en ratones). Esto a su vez, compromete la barrera cutánea y aumenta la colonización por S. aureus.
El papel protector de la barrera cutánea es atribuible a los péptidos antimicrobianos (PAM) que son péptidos pequeños disponibles en grandes cantidades dentro de la piel. Los PAM como las β-defensinas, la catelicidina, y la dermicidina son menos abundantes en la piel con DA debido a la presencia de citocinas Th2, lo que hace que piel sea permisiva a la colonización por S. aureus. De manera interesante, las cepas de estafilococos coagulasa negativo (CoNS) que expresan PAM son abundantes en la piel normal, pero rara vez se detectan en lesiones de DA. De manera reciente, Nakatsuji et al reportaron que los PAM producidos por especies comensales CoNS Staphylococcus epidermidis y Staphylococcus hominis sinergizan con el PAM humano catelicidina en la muerte del S. aureus (estudio en ratones), lo que sugiere que las interacciones entre las comunidades microbianas dentro de la piel desempeñan un papel central en la patogenia de la DA.
La microbiota fúngica también se afecta por la integridad de la barrera epidérmica. la disfunción de barrera de la piel muestra correlación positiva con la gravedad de la DA y la PTEA. Tiene correlación negativa con el pH de la piel. Se cree que las alteraciones significativas en el pH de la piel, la PTEA y la composición de lípidos en la DA desempeñan un papel importante en el cambio de la microbiota fúngica.
2.3. Biofilms estafilocócicos en DA
En la gravedad de la DA influye de forma significativa la capacidad de los aislamientos de S. aureus para formar biopelículas, que es un conjunto bacteriano unido a la superficie y encerrado en una matriz extracelular. Estudios recientes reportaron biopelículas estafilocócicas que colonizan los conductos ecrinos adyacentes a las lesiones de DA, donde tanto las citocinas inflamatorias DA tempranas (IL-1β) como tardías (IFN-γ) inducen crecimiento de cepas de S. aureus productoras de biopelículas de forma dependiente de la concentración (estudio in vitro). Un número de estudios in vitro destacó la importancia de las biopelículas estafilocócicas en la patogénesis de la DA y demostraron impactos significativos de las biopelículas estafilocócicas en el sistema inmune evasión así como la diferenciación y la apoptosis de los queratinocitos. Se conocen que los neutrófilos se inhiben por el S. aureus vía las lisinas neutrofílicas como la toxina α, que se regula por la formación de biopelículas del S. aureus. Además, la fagocitosis de macrófagos se inhibe por proteínas específicas secretadas de biopelículas de S. aureus (es decir, toxina alfa, leucocidina A, leucocidina B). Al lado de las propiedades de evasión inmune que conducen a infecciones recurrentes y difíciles de tratar, las biopelículas estafilocócicas ejercen efectos de forma directa sobre los queratinocitos. Un impacto significativo de forma potencial del S. aureus en pacientes con DA es su capacidad para desencadenar la apoptosis en los queratinocitos con la liberación posterior de linfopoyetina del estroma tímico (TSLP). La secreción de TSLP produce una respuesta pruriginosa fuerte y puede también inducir la activación de células dendríticas dérmicas y el reclutamiento de células Th2 que secretan IL-4 e IL-13, que tienen un efecto supresor sobre los PAM. Los extractos de biofilm inducen a los queratinocitos a secretar IL-6, lo que causa una disminución de la expresión de queratina 1 y 10, así como filagrina que hace que los queratinocitos sean más susceptibles a los efectos citotóxicos de la toxina estafilocócica α. Las biopelículas de S. aureus también pueden ser una fuente de enzimas proteolíticas (es decir, estafopaínas) en la superficie de la piel, con la capacidad de escindir los PAM endógenos e interferir con la respuesta inflamatoria epidérmica.
2.4. El S. aureus daña la barrera de la piel y exacerba la inflamación en la DA
Además de tener excelentes mecanismos de adhesión y de evitación inmunológica por medio de biopelículas, el S. aureus tiene una serie de recursos poderosos que ayudan a invadir y alterar la barrera cutánea (hallazgos in vitro). El S. aureus segrega una toxina α formadora de poros que penetra la membrana de la célula huésped. En la epidermis la toxina α forma poros directos sobre los queratinocitos, lo que disuelve la barrera cutánea. El S. aureus también produce una serie de proteasas, que disuelven el estrato córneo. De manera notable, la actividad proteasa se magnifica en entornos donde las citocinas Th2 están presentes y donde la filagrina está ausente. Además de la secreción de proteasa, el S. aureus activa de forma directa las proteasas de los queratinocitos, que incluyen las calicreínas KLK6, 13 y 14. Estas serina proteasas degradan la desmogleína-1 durante la descamación normal, pero la desregulación en su actividad puede conducir a una función deteriorada de la barrera. De manera reciente, se demostró que un producto de la pared celular del S. aureus, el ácido lipoteicoico (ALT) causa daño a la barrera cutánea al inhibir la expresión de las proteínas de la barrera epidérmica filagrina y loricrina. Esto destaca los diversos mecanismos que el S. aureus ofrece hacia la destrucción de la barrera, al aumentar la pérdida de agua y permitir una mayor exposición a antígenos externos.
El S. aureus también presenta una serie de moléculas que contribuyen a la enfermedad por medio de mecanismos proinflamatorios (hallazgos in vitro). La proteína A, una proteína de superficie que se encuentra de forma original en la pared celular del S. aureus, induce una respuesta inflamatoria de los queratinocitos al unirse a receptor 1 del factor de necrosis tumoral (TNFR1). Los súper antígenos estafilocócicos como la toxina 1 del síndrome de choque tóxico (TSST-1) y la enterotoxina estafilocócica A (EEA), la EEB, la EEC, desencadenan la expansión de las células B, y la liberación de citocinas. De manera dependiente del receptor tipo toll (RTT)-2/RTT-6, las lipoproteínas estafilocócicas proinflamatorias provocan a los queratinocitos para expresar TSLP, lo que confirma que existen múltiples rutas por medio de las cuales el S. aureus provoca una respuesta Th2 persistente y autoperpetuante. El S. aureus también libera modulinas solubles en fenol (MSF), que impulsan la inflamación con efectos específicos al sector. En la epidermis, la MSF α desencadena a los queratinocitos para producir IL-36, y causa inflamación impulsada por IL-36 α mediada por células T γδ, mientras que en la dermis, activa la inflamación Th17 operada por la IL-1β e impulsada por las células linfoides innatas. La MSF γ (toxina δ) estimula a los mastocitos dérmicos y promueve la inflamación cutánea.
2.5. Disbiosis cutánea y DA
La colonización por S. aureus en la piel con DA es común y puede hacer que el curso de la DA sea más complejo. A pesar del conocimiento, la asociación causal entre disbiosis y DA aún no se aclara. Los últimos estudios en múridos muestran que la flora cutánea puede afectar la evolución del sistema inmunitario y la enfermedad de la piel. Descubrir si la flora cutánea participa en el comienzo de la DA puede dar la oportunidad de prevenir los trastornos atópicos. Para abordar esto, se realizaron estudios prospectivos a gran escala que analizan la microbiota de manera longitudinal. Kennedy y colaboradores reportaron que los infantes de dos meses que se diagnosticaron con DA más tarde portaban un número menor de forma significativa de especies de Staphylococcus comensales en la fosa antecubital en comparación con aquellos que no se afectaron a los 12 meses. No pudieron detectar colonias sustanciales de S. aureus en infantes que luego desarrollaron DA, y llegaron a la conclusión de que la colonización por S. aureus sigue al inicio de la DA. Meylan y colaboradores presentaron un estudio longitudinal de 149 infantes durante sus primeros 2 años para encontrar colonias aumentadas de S. aureus antes del comienzo de la DA. En el mismo estudio, se descubrió que el Staphylococcus hominis era menos copioso de forma significativa en aquellos que desarrollaron DA más adelante. Aunque hay datos contradictorios sobre el S. aureus, su papel en el inicio de DA se respalda por varias líneas de evidencia. Cepas de S. aureus aisladas de los pacientes con DA secretan varias exotoxinas y se descubrió que los niños con manifestaciones graves portaban cepas toxigénicas de S. aureus con mayor frecuencia. También se encontró una relación causal entre el S. aureus y la DA en experimentos en múridos. Kobayashi y colaboradores mostraron que la inoculación de S. aureus acelera el desarrollo de un eccema similar a la DA. La exposición temprana a estafilococos comensales puede proteger de desarrollar DA más adelante.. Tener una tolerancia específica al antígeno a la flora comensal depende de la colonización temprana, lo que indica que hay un período sensible para generar células T reguladoras para estas bacterias (estudio en ratones). Al comparar a los lactantes con una población mayor, la activación de los RTT da como resultado menos TNF-α y una mayor producción de IL-23 e IL-6. El sistema inmunitario adaptativo madura junto con las células T reguladoras que se encuentran en mayor cantidad durante la vida fetal y la infancia. Aunque estas características ponen a los recién nacidos en mayor riesgo de infección diseminada, también estimulan la tolerancia inmune a los antígenos extraños y propios, para bloquear así la inflamación desfavorable. Scharschmidt y colaboradores aplicaron una especie de Staphylococcus comensal en ratones neonatales para producir con éxito la modulación inmune. No se sabe si la exposición temprana a estafilococos comensales en humanos tiene un efecto similar. Se requiere más investigación para comprender por completo su influencia en el desarrollo de la DA. Los estudios longitudinales se centraron en S. aureus y en la actualidad hay poca información sobre el papel de los hongos, los virus y las bacterias Gram-negativas en el desarrollo de la DA.
2.6. Efecto del tratamiento sobre la microbiota cutánea en la DA
La diversidad microbiana y la proporción de Staphylococcus varía entre estados específicos de la enfermedad DA. Kwon et al evaluaron los cambios en la microbiota cutánea lesional y no lesional durante el tratamiento de la DA (fototerapia ultravioleta B de banda estrecha (UVBBE) y corticoesteroides tópicos versus corticoesteroides tópicos solos) para encontrar un aumento drástico en la diversidad microbiana y una disminución en la proporción de S. aureus en la piel lesionada después del tratamiento. La diversidad de Shannon de la piel no lesional del grupo UVBBE + corticoesteroides tópicos aumentó en la semana 6, mientras que la población de corticoesteroides tópicos solos permaneció similar. El efecto de la terapia con UVBBE en la DA se documentó bien en varios estudios, y algunos hallazgos de la investigación sugieren que su papel protector se logra al restaurar la disbiosis de la piel con DA. Estudios anteriores encontraron que la fototerapia ultravioleta reduce la colonización de S. aureus en la piel con DA dañada y reduce la producción de toxinas de S. aureus. La exposición a los rayos ultravioleta también induce una producción de catelicidina AMP en la piel con DA, lo que protege la piel del S. aureus. En otro estudio con DA y niños sanos, se evaluó la influencia de los esteroides tópicos más los baños con cloro diluido y los esteroides tópicos solos. Ambos brazos de tratamiento normalizaron la composición bacteriana de la piel lesionada a la de la piel no lesional, y la diversidad de la flora cutánea fue comparable a la de la piel control. El baño con blanqueador no tuvo un impacto adicional en la flora de la piel. En un estudio de Kong et al, se analizó la naturaleza de las comunidades bacterianas durante los estados de enfermedad de DA para analizar las características microbianas relacionadas con los brotes de DA (definidos como empeoramiento de la enfermedad durante más de 24 h, de manera independiente de cualquier intervención antes del muestreo) y la mejora después de tratamiento. La diversidad de la flora de la piel durante los brotes de DA correlacionó con la presencia o ausencia de tratamientos recientes para la DA, donde incluso el tratamiento esporádico (uso de inhibidores de calcineurina tópicos/esteroides/o antibióticos en los últimos 7 días y/o consumo de antibióticos orales dentro de las 4 semanas antes del muestreo) se relacionó con la reducción de S. aureus y una mayor diversidad bacteriana. Dado que el tratamiento para los brotes esporádicos se presenta como una enfermedad empeorada de forma clínica, los autores sugieren que es necesario un tratamiento continuo durante un amplio período de tiempo para alcanzar el estado de “resolución de brote”, donde hay una recuperación completa de la diversidad microbiana y la reducción en la población de estafilococos, típica de un verdadero brote posterior.
3. Microbiota intestinal y DA
Las células bacterianas dentro del intestino humano dominan en número a las células del huésped por un factor de 10 y los genes codificados por estas bacterias superan en número a los genes de su huésped en más de 100 veces. Los microbios vinculados con el tracto digestivo humano se citan como la microbiota intestinal. Se realizó una investigación amplia sobre la microbiota intestinal humana y su papel en la enfermedad y el estado saludable, para identificar la interacción de la microbiota intestinal con la nutrición, el metabolismo, la fisiología y la función inmune.
Los microbios colonizan el intestino neonatal desde el nacimiento y continúan en evolución en abundancia de especies hasta que el infante tiene 2 a 3 años, momento en el que la flora se vuelve adulta. Varios estudios muestran que el modo de nacimiento influye en el desarrollo de la microbiota intestinal en la vida temprana. El parto vaginal causa exposición a la flora vaginal materna, compuesta de organismos comensales que a menudo se encuentran en el tracto gastrointestinal inferior. Ciertas especies de Bifidobacterium y Bacteroides con efectos promotores de la salud son muy abundantes en estos infantes, lo que permite la disminución de la expresión de las respuestas inflamatorias.
Por otro lado, una comunidad microbiana aberrante, predominante con especies de Streptococcus, especies de Staphylococcus y C. difficile se encuentra en los recién nacidos por cesárea. Los métodos de alimentación infantil, como la alimentación con fórmula y la alimentación con leche materna, influyen de gran manera en la composición de la microbiota intestinal en la vida temprana. Los lactantes alimentados con biberón están enriquecidos con Escherichia coli (E. coli) y Clostridium (ex. C. difficile), mientras que los lactantes alimentados con leche materna muestran abundancia de un tipo específico de Bifidobacterium. La introducción de alimentos sólidos produce un cambio dinámico en la flora intestinal de la composición dominante de Bifidobacterium a Bacteroides y Clostridium dominante. Estas microbiotas persisten durante la edad adulta en ausencia de trastornos como enfermedades graves, cambios en la dieta o uso prolongado de antibióticos.
La colonización bacteriana intestinal en la vida temprana (primeros 3 años) tiene un gran impacto en el sistema inmunitario del huésped, lo que afecta la salud y la enfermedad del huésped más adelante en la vida. El desarrollo adecuado del sistema inmune depende en gran medida de las bacterias intestinales, como lo demuestra la pérdida de la función inmune en ratones libres de gérmenes. Estudios anteriores en humanos y animales demostraron que la flora intestinal y sus metabolitos (es decir, ácidos grasos de cadena corta [AGCC]) participan de forma activa en la proliferación y la diferenciación de células B y células T, lo que induce respuestas de anticuerpos protectores.
3.1. Microbiota intestinal en la DA
La naturaleza de la microbiota intestinal en pacientes con DA y sus controles emparejados por sexo y edad se analizaron de forma previa. En el estudio de Watanabe et al los recuentos de Bifidobacterium en pacientes con DA fueron menores de forma significativa (7.6+5.0 años) que en individuos sanos. Además, el recuento y el porcentaje de Bifidobacterium diferían según el estado de la enfermedad, donde se encontraron números más bajos en aquellos con DA grave pero no en pacientes con síntomas atópicos leves. En contraste directo, Staphylococcus fue más abundante en pacientes con DA que en individuos sanos. Song y colaboradores demostraron que el enriquecimiento de la subespecie Faecalibacteriuim prausnitzii(F. prausnitzii) (F06) está muy relacionado con la DA (causalidad no probada). Fieten y colaboradores identificaron una firma microbiana que distingue a los niños DA con alergia alimentaria.
La microbiota fecal de los niños DA con alergia alimentaria tenía de manera relativa más Bifiobacterium pseudocatenulatum (B. pseudocatenulatum) y E. coli y menos Bifiobacterium adolescentis (B. adolescentis), Bifiobacterium breve (B. breve), F. prausnitzii y Akkermansia muciniphila (A. muciniphila) que las personas sin alergia alimentaria. La diversidad microbiana (según el índice de Shannon) fue en gran medida indiferente entre los niños con DA y sin alergia alimentaria.
3.2. Asociación entre la disbiosis intestinal y la DA
La colonización bacteriana de los intestinos y el establecimiento de la flora intestinal en la infancia se relacionan de forma estrecha con desarrollo del sistema inmune. De hecho, los resultados de los estudios de numerosas cohortes sugieren que la microbiota intestinal aberrante precede al inicio de la enfermedad atópica. La DA, la manifestación cutánea de atopia, suele ser el primer paso en la marcha atópica. Algunos estudios de cohortes encontraron que los infantes con DA tienen una falta de diversidad bacteriana además de cantidades bajas de Bifidobacterium y Bacteroides y niveles altos de Enterobacteriaceae. Fujimura y colaboradores afirmaron que los infantes con riesgo mayor de atopia como DA y asma muestran niveles bajos de Akkermansia, Bifidobacterium y Faecalibacterium, y grandes cantidades de Candida y Rhodotorula. Se reportó que los infantes atópicos (aquellos con pruebas cutáneas por punción positivas a los 12 meses) tenían niveles elevados de Clostridium y niveles reducidos de Bifidobacteriumen sus heces a las 3 semanas de edad. La colonización por C. difficile en los primeros años de vida también condujo al desarrollo posterior de DA en otros estudios. Ismail y colegas demostraron que, entre aquellos con riesgo alto de enfermedad alérgica, los infantes que tenían microbiota intestinal diversa a la edad de 1 semana tenían un riesgo más bajo de DA. La reducción de la biodiversidad de la flora intestinal y la demora en la colonización por Bacteroidetes en los lactantes de un mes de edad también se asociaron con DA posterior. Similar a los comensales de la piel, se cree que las diferencias en la microbiota del intestino a nivel de especie se relacionan con la enfermedad. Los infantes con alergia más a menudo llevan B. adolescentis, mientras que en los infantes sanos, B. bifidum es la cepa dominante entre la población de Bifiobacterium. En un estudio prospectivo de cohorte de nacimiento a gran escala (KOALA), los infantes con DA estaban más colonizados de gran manera con C. difficile y E. coli en comparación con aquellos sin DA.
Como se mencionó de forma previa, la flora intestinal establecida durante la infancia, que incluye el período de destete, es crítica para el desarrollo del sistema inmune. La transformación de células T vírgenes en diferentes tipos de células Th como Th1, Th2 y Th17 o células T reg cabeza de tenedor caja P3 (Foxp3)+ depende en gran medida de la flora intestinal. Las células T reg evitan que las células T no expuestas se diferencien en células Th y controlan la inflamación al disminuir las actividades celulares de los mastocitos, los eosinófilos y los basófilos. También suprimen la producción de IgE e inducen IgG4. Bifidobacterium, Lactobacillus, Clostridium, Bacteroides y Streptococcus, y sus productos metabólicos ácido butírico y ácido propiónico, son bien conocidos por su capacidad para inducir células T reg. Las células T reguladoras se desarrollan en el timo (tTreg) pero las células T vírgenes también pueden transformarse en células Treg en la periferia (pTreg). De los dos, las células T reguladoras extratímicas (pTreg) controlan la inflamación Th2 de la mucosa. Estudios recientes reportan que la flora intestinal y el factor de simbiosis de Bacteroides fragilis (polisacárido A) promueven la generación de células pTreg. En cuanto a las células T auxiliares, cada tipo de la célula Th desempeña su propio papel en la configuración de la respuesta inmune y genera citocinas para bloquear la actividad de otras células Th. Las células Th17 secretan IL-17, IL-17F e IL-22 y participan en el mantenimiento la función de barrera del tracto gastrointestinal y contribuyen a la eliminación de patógenos en la superficie de la mucosa. El ADN no metilado, los flagelos bacterianos y la adenosina trifosfato (ATP) son mediadores clave que impulsan la diferenciación Th17. La interacción mutua entre las células Th1 y Th2 es importante para la homeostasis y el sesgo Th1 o Th2 puede provocar inflamación crónica y condiciones autoinmunes o alérgicas.
En dos estudios metagenómicos coreanos, se encontró disbiosis significativa de especies de F. prausnitzii en las muestras fecales de pacientes con DA. También se observó disminución concurrente de AGCC, que participan en el mantenimiento de la integridad de la barrera epitelial y poseen un efecto antiinflamatorio. La “fuga intestinal” en pacientes con DA impulsa la inflamación de la piel al permitir la penetración de toxinas, alimento mal digerido, y microbios, en la circulación sistémica. A medida que llegan a la piel, se inicia una respuesta Th2 fuerte, que causa daño tisular significativo (Figura 3).
La microbiota intestinal también da forma a la flora de la piel. Los AGCC (es decir, propionato, acetato, butirato) son productos finales de la fermentación de la fibra dietética en el intestino y se sabe que toman una parte importante en determinar la composición microbiana de la piel que se relaciona de forma estrecha con mecanismos de defensa del sistema inmune cutáneo.. Cutibacterium, produce acetato y ácido propiónico en el intestino, que son AGCC. El ácido propiónico y sus derivados esterificados suprimen el crecimiento del Staphylococcus aureus resistente a meticilina USA300 (estudio in vitro). Mientras tanto, comensales cutáneos como S. epidermidis y C. acnes toleran cambios más amplios de AGCC que otros. En conjunto, los hallazgos sugieren que existe una interacción mutua entre el intestino y la piel.
En un estudio alemán con neonatos de riesgo alto para DA, el modo de nacimiento tenía efectos profundos sobre la incidencia de la DA, que probablemente se deban a la perturbación de la flora intestinal (con una abundancia del grupo Clostridium I). El mismo estudio también afirmó que existe una influencia beneficiosa de los hermanos mayores en el desarrollo de la microbiota intestinal, que de manera posterior conduce a menos DA. El análisis de mediación de los resultados sugiere que por medio de la modulación microbiana, factores como la presencia o ausencia de hermanos, y el modo de nacimiento pueden influir en el riesgo de DA.
4. Impacto de los probióticos/prebióticos en la DA
Dado que la DA se asocia con la disbiosis, la modulación selectiva de la flora del huésped para tratar la DA se convierte en un centro de interés. La flora intestinal puede normalizarse mediante el uso de pro, pre o simbióticos. Los probióticos son bacterias vivas y levaduras reconocidas por tener varios beneficios para la salud. Cuando se ingieren, los probióticos proporcionan beneficios al interactuar con la flora intestinal y también cuando se aplican sobre la piel por medios tópicos, al modular la microbiota de la piel. Los prebióticos contienen fibras no digeribles no vivas que estimulan el crecimiento y la actividad de microorganismos beneficiosos.. Los simbióticos son una combinación sinérgica de probióticos y prebióticos que promueven una piel sana y un equilibrio conjunto de bacterias gastrointestinales.
Los Gram-positivos Bifidobacterium y Lactobacillus son familias probióticas populares. Carecen de lipopolisacáridos que causan inflamación y liberan moléculas activas que ayudan a mantener un intestino y piel sanos. Los probióticos modulan el sistema inmunitario al estimular la diferenciación de las células T reguladoras, y también mediante la producción de citocinas antiinflamatorias (TGF-β e IL-10) En un estudio con ratones, la inyección intraperitoneal de una cepa de Lactobacillus causó un aumento de IL-12 y una disminución en la IgE, que en teoría puede ser beneficioso en anafilaxia, alergia alimentaria y DA. El Lactobacillus demostró que acelera la recuperación de la barrera cutánea e inhibe la inflamación de la piel relacionada con la sustancia P. El Bifidobacterium ejerce efectos antipruríticos al producir ácido quinurénico, que es un metabolito que posee actividad neuroactiva (es decir, antipruriginoso, antinociceptivo). Un ensayo reciente de probióticos con Lactobacillus y Enterococcus de origen humano reveló que los probióticos pueden aumentar la producción de AGCC, y fortalecer así la barrera mucosa (Figura 4).
De manera desafortunada, el efecto de los probióticos en estudios humanos muestra resultados contradictorios. De acuerdo con un ensayo doble ciego controlado con placebo, Lactobacillus rhamnosus GG (L. rhamnosus GG) tomado en el embarazo evitó que la mitad de los lactantes de alto riesgo desarrollaran DA a los 2 años, y este efecto se mantuvo constante a la edad de 4 años. Otro grupo reportó que los infantes destetados que recibieron Bifidobacterium lactis (B. lactis) Bb-12 o L. cepa GG desarrollaron DA que fue menos grave de forma clínica. Sin embargo, en un estudio más reciente, la suplementación de L. rhamnosus GG durante el embarazo y la primera infancia no redujo la incidencia y la gravedad de la DA en los niños afectados. Por otra parte, la suplementación con probióticos aumentó los episodios de bronquitis sibilante. Una revisión Cochrane reciente evaluó los efectos de los probióticos para tratar a pacientes de todas las edades con eccema y cuestiona los efectos beneficiosos de los probióticos en la DA. Según el análisis, los probióticos hicieron poca o ninguna diferencia en síntomas de eccema clasificados por el participante o los padres. Tampoco hubo evidencia de que los probióticos hagan una diferencia en la calidad de vida (QoL) para los pacientes con eccema. Los probióticos redujeron de forma ligera la calificación de los puntajes del investigador de gravedad del eccema, pero esto de nuevo no fue suficiente de forma clínica. Por lo tanto, el uso de probióticos para el tratamiento del eccema en la actualidad no se basa en la evidencia. Si bien el metaanálisis no apoya el uso de probióticos para la DA, a los autores les gustaría señalar que las variaciones entre las especies y las cepas empleadas como tratamiento pueden haber contribuido a la variación global en la respuesta.
Cierta crema hidratante que contiene biomasa de la bacteria no patógena Vitreoscilla filiformis fue beneficiosa en la normalización de la microbiota de la piel en la DA y redujo de forma significativa los episodios de brotes. La aplicación tópica de CoNS a la piel con DA (humanos y ratones) redujo la colonización de la piel por S. aureus. La aplicación tópica de un organismo gramnegativo Roseomonas mucosa mejoró la DA al disminuir el prurito, la gravedad clínica y el uso de esteroides tópicos. Los mecanismos de acción de estas bacterias ambientales aplicadas de forma tópica aún no se conocen, aunque de forma clara ejercen un efecto antiinflamatorio. Hasta ahora, solo se realizaron unos pocos estudios con probióticos tópicos. Deben realizarse otros estudios que reporten datos a largo plazo sobre los síntomas del eccema y la calidad de vida para determinar sus efectos verdaderos.
5. Vitamina D, microbiota y DA
Investigaciones recientes sugieren que los niveles sanguíneos de vitamina D correlacionan de manera inversa con la gravedad de la DA y que la vitamina D reduce de forma significativa la gravedad de la DA. Sin embargo, debido a las diferencias en los parámetros clínicos y el diseño del estudio, el tema es todavía controversial, y los investigadores aún no tienen evidencia clara para recomendar suplementos de vitamina D a los pacientes con DA. En cuanto al mecanismo propuesto de acción, la vitamina D controla la autofagia y la producción de AMP (por ejemplo, β-defensina y catelicidina) que produce la inhibición de S. aureus y un cambio en la comunidad microbiana. Se sabe que la barrera epidérmica y el sistema inmune se entrelazan de forma estrecha, y con su capacidad de acelerar la recuperación de la barrera epidérmica, la vitamina D puede estabilizar de manera potencial la integridad inmunológica del intestino y la piel. La vitamina D también regula la inmunidad innata y adaptativa en una serie de formas tales como alentar a los mastocitos a producir una citocina antiinflamatoria IL-10, que bloquea la liberación de citocinas proinflamatorias Th1, y evita que los monocitos expresen receptores tipo Toll, para reducir la actividad de las células dendríticas con lipopolisacáridos y reducir la liberación de IgE, todo lo cual sugiere que la vitamina D está involucrada al menos de manera parcial en la DA y otras condiciones inflamatorias de la piel.
En un estudio, se encontró que la suplementación materna con vitamina D ayuda a colonizar los taxones bacterianos importantes dentro del intestino del infante. Dado que la homeostasis de la flora intestinal influye en el desarrollo de la DA, debe estudiarse más a fondo la posibilidad de que la vitamina D sea un suplemento novedoso para mujeres embarazadas e infantes.
6. Contaminación del aire, microbiota intestinal y DA
La contaminación del aire es la presencia de sustancias nocivas en el aire causada por condiciones naturales (es decir, viento, polvo) y actividades humanas (es decir, tráfico, cocinar, fumar). La materia particulada (MP) es un componente clave en la contaminación del aire y se asocia con condiciones adversas de salud.
La evidencia reciente sugiere que la contaminación del aire puede ser un factor de riesgo para el desarrollo de DA con su capacidad de inducir estrés oxidativo. Lee y colaboradores reportaron que la DA flexural se asociaba con contaminantes del aire en niños taiwaneses en edad escolar. Otro estudio con niños de 9 a 11 años identificó que el eccema se relacionaba con la concentración de los principales contaminantes del aire (es decir, monóxido de carbono, óxido nítrico, MP) (causalidad no probada en ambos estudios).
Mutlu y colaboradores mostraron que la exposición a la MP aumenta la producción mitocondrial de especies reactivas de oxígeno (ROS) y la liberación de citocinas proinflamatorias, lo que aumenta la permeabilidad intestinal. Esto puede afectar de manera potencial la dinámica de la microbiota intestinal que resulta en disbiosis. La proporción de Firmicutes fue baja de forma significativa en ratones expuestos a MP, lo que explica la desaparición de Lactobacillus que se sabe que es un comensal beneficioso en el intestino. Además, la exposición intestinal a la MP resultó en una disminución en la concentración de butirato que se asocia con disfunción de barrera e inflamación de la mucosa.
Como se mencionó de forma previa en este documento, la microbiota intestinal se desarrolla en interacción estrecha con el sistema inmune.. Una colonización microbiana aberrante en la vida temprana puede producir un desequilibrio y desregulación del sistema inmune, lo que genera una variedad de resultados patológicos (es decir, DA).
7. Conclusiones
Los avances tecnológicos recientes en la secuenciación de la próxima generación fortalecieron la capacidad para encontrar y categorizar comunidades microbianas de la piel y el intestino. El entendimiento sobre flora saludable, y cómo se desplaza en el estado de la enfermedad (es decir, la DA) está en aumento de manera constante. Sin embargo, sería necesaria más investigación para incorporar este conocimiento a la terapia. La modulación de la microbiota pre, pro y simbiótica es un enfoque novedoso para mejorar la salud del huésped. Aunque en la actualidad hay poca evidencia de que los probióticos prevengan/traten la DA, puede convertirse una alternativa en la futura era “postantibiótico”. El nacimiento vaginal normal, la alimentación con leche materna, la suplementación de vitamina D a mujeres embarazadas e infantes, y la restricción de antibióticos al principio de la vida pueden reducir el riesgo de DA. El microbioma es muy personal y es una faceta importante en la salud de los humanos. Quizá se aplique medicina de precisión y personalizada con el microbioma para el tratamiento de la DA en el futuro.
Microbiome of the Skin and Gut in Atopic Dermatitis (AD): Understanding the Pathophysiology and Finding Novel Management Strategies
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Bárbara Elizondo Villarreal Profesor
Dra. Argentina Rodríguez Casas Residente 1er Año
Dra. Alejandra Macías Weinmann Profesor







No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.