La enfermedad celíaca se define en general como una enteropatía crónica inmunológica mediada impulsada por el gluten en la dieta, que está presente en los cereales, como el trigo, el centeno y la cebada. Además de la ingestión de gluten, el desarrollo de la enfermedad celíaca requiere de susceptibilidad genética y el trastorno ocurre casi de forma exclusiva en individuos con el haplotipo de antígeno leucocitario humano (HLA) -DQ2 y/o HLA-DQ8. Sin embargo, como sólo una fracción de los individuos positivos para HLA-DQ2 y/o HLA-DQ8 que consumen gluten desarrollan el trastorno, es probable que otros factores genéticos y/o ambientales desempeñen un papel en la aparición de la enfermedad.
La enfermedad celíaca es más frecuente en las mujeres, puede desarrollarse a cualquier edad después de la introducción del gluten en la dieta y puede afectar casi a cualquier etnia. La enfermedad celíaca afecta sobre todo a la mucosa del intestino delgado, y la ingestión de gluten por parte de individuos predispuestos da como resultado el desarrollo de una respuesta inmunitaria de la mucosa, que incluye un aumento en el recuento de linfocitos intraepiteliales (LIE), y tales respuestas inmunitarias de manera eventual conducen a cambios estructurales en el intestino, caracterizados por atrofia de las vellosidades (reducción o aplanamiento de las vellosidades) e hiperplasia de las criptas (elongación de las criptas). La enteropatía asociada a la enfermedad celíaca suele acompañarse de síntomas gastrointestinales y signos de malabsorción. Sin embargo, las manifestaciones clínicas de la enfermedad celíaca son amplias y, además de los problemas gastrointestinales, los pacientes pueden experimentar diversos síntomas extraintestinales o incluso permanecer asintomáticos. Tal heterogeneidad clínica complica realizar el diagnóstico, que puede demorar el diagnóstico o permitir que la enfermedad permanezca sin ser reconocida. Como era de esperar, la enfermedad celíaca está muy poco diagnosticada en todo el mundo. Además, la enfermedad celíaca no tratada puede asociarse con complicaciones graves de salud, mayor morbilidad y mortalidad, carga considerable para los sistemas de atención de salud y disminución de la calidad de vida del paciente (QOL). En la actualidad, el único tratamiento efectivo es una dieta estricta sin gluten durante toda la vida, que resulte en la recuperación del daño de la mucosa del intestino delgado junto con la mejoría en los síntomas clínicos. Existe evidencia que sugiere que el tratamiento temprano con una dieta libre de gluten también podría prevenir el desarrollo de complicaciones asociadas con la enfermedad celíaca.
En este Manual, se analiza la epidemiología, la fisiopatología, el diagnóstico, el cribado y la prevención, así como el tratamiento y los problemas de calidad de vida asociados con esta entidad nosológica inducida por el gluten, la enfermedad celíaca.
Epidemiología
Prevalencia e incidencia
Antes de la década de 1990, la enfermedad celíaca se consideraba un trastorno poco común que afectaba sobre todo a los niños y se limitaba a Europa occidental. Mejoras en el diagnóstico, como la implementación de pruebas serológicas específicas para la enfermedad celíaca (anticuerpos contra la transglutaminasa 2) (anticuerpos TG2) y anticuerpos endomisiales (EmAs); llevan a un mayor reconocimiento de la enfermedad celíaca, además de permitir estimar la prevalencia real del trastorno en la población general.
En 2015, una revisión sistemática de los estudios de detección indicó que la enfermedad celíaca es ahora un problema importante de salud pública, ya que la seroprevalencia global combinada medida por anticuerpos TG2 y EmAs en la población general puede ser tan alta como 1.4% (IC de 95%: 1.1-1.7 %). La mayoría de los estudios de detección se realizan en Europa, y los resultados muestran variaciones entre los diferentes países. Los países de prevalencia alta en Europa incluyen Suecia, Finlandia, Turquía, Reino Unido, Italia, República Checa y Portugal, mientras que en Rusia, Estonia, Islandia, Polonia y Suiza, la enfermedad celíaca es menos común. En total, se estima que la enfermedad celíaca afecta aproximadamente ~ 1% de la población europea. Estudios similares realizados en áreas con niveles altos de ascendencia europea, como en América del Norte, América del Sur y Oceanía, arrojan cifras de prevalencia comparables a las de Europa. También se reportan datos basados en la población sobre la prevalencia de la enfermedad celíaca en la India y en algunos países del Medio Oriente asiático y África (Fig. 1). De los diez países más poblados del mundo, los datos de prevalencia poblacional sobre la enfermedad celíaca están disponibles en India, Estados Unidos, Brasil y Rusia, pero faltan en gran parte en China, Indonesia, Pakistán, Nigeria, Bangladesh y Japón. En conjunto, ahora se sabe que la enfermedad celíaca afecta a personas de todo el mundo. En algunas áreas geográficas, como el Lejano Oriente de Asia y el África subsahariana, la enfermedad es todavía poco frecuente, aunque todavía faltan estudios epidemiológicos grandes en estos sitios. La mayoría de los estudios epidemiológicos basados en la población sobre la prevalencia de la enfermedad celíaca se basan en datos serológicos, y el diagnóstico de la enfermedad celíaca en todos los pacientes seropositivos no se confirma mediante biopsias invasivas de mucosa del intestino delgado. Por lo tanto, la prevalencia global agrupada de la enfermedad celíaca comprobada por biopsia, que es de 0.7% (IC de 95%: 0.5-0.9%), es inferior a la seroprevalencia. De manera interesante, de acuerdo con los datos serológicos, la prevalencia de la enfermedad celíaca está en aumento en el transcurso el tiempo. Dos estudios reportaron un aumento de 2 veces en la seroprevalencia de la enfermedad celíaca durante dos décadas, y un estudio adicional con ~50 años de seguimiento indicó un aumento de 4-4.5 veces con el tiempo. Un metaanálisis reciente también confirmó un aumento paralelo en la prevalencia de enfermedad celiaca comprobada por biopsia.
Aunque la prevalencia de la enfermedad celíaca en la población general va en aumento, el trastorno aún no se reconoce. Las cifras de seroprevalencia de la enfermedad celíaca sugieren que por cada paciente diagnosticado por clínica con enfermedad celíaca, un promedio de cinco a diez individuos seropositivos permanecen sin diagnosticar, en general debido a síntomas atípicos, mínimos o incluso ausentes. La tasa del diagnóstico depende sobre todo del nivel de conocimiento del médico y, con una búsqueda activa de pacientes, se puede alcanzar una prevalencia clínica de hasta 0.7% de la enfermedad celíaca, que aún queda de forma clara detrás de la correspondiente seroprevalencia.
Factores de riesgo
Los factores que explican la prevalencia variable y creciente de la enfermedad celíaca persisten desconocidos. Existe variación en la frecuencia de haplotipos HLA predisponentes de la enfermedad celiaca en todo el mundo, pero la prevalencia de la enfermedad celiaca también varía en poblaciones con antecedentes similares de HLA. Dicha variación puede explicarse por factores ambientales más que genéticos. Los posibles factores ambientales incluyen el consumo de cereales que contienen gluten, la infección en los primeros años de vida y un estado económico más bajo, así como un entorno higiénico inferior. Al considerar las cifras de prevalencia de la enfermedad celíaca, es importante tener en cuenta que la edad de los individuos en la población de estudio puede afectar los resultados. También es de destacar que la prevalencia de la enfermedad celíaca varía según el sexo, al ser más común en las mujeres. Por último, la presencia de ciertos trastornos se asocia con un mayor riesgo de desarrollar enfermedad celíaca (Caja 1).
Mecanismos/fisiopatología
El antígeno propulsor: el gluten en la dieta
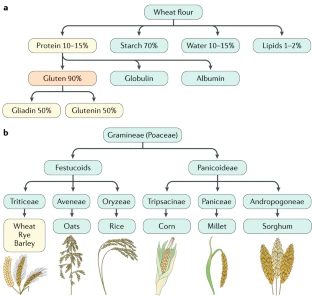
El gluten de manera común se refiere a las principales proteínas de almacenamiento, las prolaminas del trigo, el centeno y la cebada, que son perjudiciales para los pacientes con enfermedad celíaca. Como un componente estructural importante de estos cereales, el gluten también es esencial para la formación de la masa debido a sus propiedades viscoelásticas únicas. El gluten de trigo es una mezcla compleja de gliadinas solubles en alcohol (divididas en α-gliadinas, γ-gliadinas y ω-gliadinas) y gluteninas insolubles en alcohol (divididas en gluteninas de masa molecular alta y masa molecular baja) (Fig. 2). Las gliadinas y las gluteninas son en particular ricas en los aminoácidos prolina y glutamina; el contenido alto de prolina hace que estas proteínas sean bastante resistentes al procesamiento proteolítico por enzimas gástricas y pancreáticas, así como enzimas de membrana del borde en cepillo del intestino delgado de los mamíferos (Fig. 3). Como resultado, se generan varios péptidos largos de gliadina en el tracto gastrointestinal que son capaces de activar las respuestas inmunitarias perjudiciales observadas en pacientes con enfermedad celíaca. De estos, el más estudiado es el “33mer”, que contiene 6 epítopos superpuestos de manera parcial, perjudiciales en potencia y de forma frecuente se describe como la secuencia inmunogénica celíaca más importante dentro del gluten. Además de desencadenar una respuesta inmune en pacientes con enfermedad celíaca, los péptidos no digeridos están disponibles para el metabolismo bacteriano intestinal del gluten, ya que constituyen una fuente atractiva de energía, que puede afectar la microbiota intestinal (que se describe a continuación).
Avena spp.(avena) está relacionada de forma taxonómica con los cereales Triticeae (trigo, centeno y cebada) (Fig. 2b), pero el contenido de prolamina correspondiente en la avena (es decir, avenina) es más bajo de forma sustancial. Además, hay menos residuos de prolina y glutamina en las aveninas que en las prolaminas, que son perjudiciales para los pacientes con enfermedad celíaca. Es probable que estas características expliquen la seguridad de la avena dietética para la mayoría de los pacientes con enfermedad celíaca, como se verá más adelante.
Genética
El desarrollo de la enfermedad celíaca requiere tanto la ingestión de gluten como la predisposición genética. La susceptibilidad genética de la enfermedad celíaca se evidencia por el hecho de que la prevalencia promedio de la enfermedad celíaca entre los familiares de primer grado de los pacientes supera la de la población general, que es aproximadamente ~8%. De los factores genéticos identificados hasta la fecha, los haplotipos HLA-DQ HLA-DQ2 y HLA-DQ8 son los que presentan el mayor riesgo, y se estima que estas variantes contribuyen ~25-40% del riesgo genético. Cabe destacar que ~40% de las poblaciones norteamericanas y europeas también tienen estos haplotipos, y la gran mayoría de ellos nunca desarrollan la enfermedad celíaca; como tal, HLA-DQ2 o HLA-DQ8 son necesarios pero no son suficientes para que se desarrolle la enfermedad celíaca.
HLA-DQ2 y HLA-DQ8 son moléculas diméricas clase II del complejo mayor de histocompatibilidad expresadas en la superficie de las células presentadoras de antígenos (CPA); consisten en una cadena α y una cadena β codificadas por variantes específicas de los genes HLA-DQA1 y HLA-DQB1, de forma respectiva. HLA-DQ2 se codifica por los alelos HLADQA1*05:01 y HLADQB1*02:01 (también llamado HLA-DQ2.5), mientras que HLA-DQ8 se codifica por los alelos HLADQA1*03 y HLADQB1*03:02. Más de 90% de los pacientes con enfermedad celíaca son positivos para HLA-DQ2 y casi todo el resto lleva HLA-DQ8. Otras variantes de HLA-DQ que rara vez se asocian con la enfermedad celíaca son HLA-DQ2.2 y HLA-DQ7.5. De forma interesante, la dosis génica de HLA-DQ se asocia con el riesgo de enfermedad celíaca; en consecuencia, los individuos homocigotos para HLA-DQ2.5 tienen el mayor riesgo de la enfermedad.
Además de HLA, 42 regiones diferentes a HLA se asocian con la enfermedad celíaca; de manera interesante, muchos de estos loci albergan genes en particular vías enriquecidas en la enfermedad celíaca (Tabla 1). Sin embargo, el efecto de riesgo de estas variantes no HLA es bastante modesto, y se estima que representan aproximadamente 15% del riesgo genético de la enfermedad celíaca. En conjunto, todas las variantes genéticas identificadas hasta la fecha, incluido el HLA, explican sólo ~50% de la varianza genética en la enfermedad celíaca, y factores hereditarios adicionales, que esperan identificación pueden existir de forma potencial.
Mecanismos inmunes
Los péptidos del gluten que resultan de una digestión incompleta en la luz intestinal obtienen acceso a la lámina propia a través de la barrera epitelial vía la ruta transcelular o paracelular. En pacientes con enfermedad celíaca, estos péptidos dañinos inician la activación de respuestas inmunitarias tanto adaptativas como innatas.
Generación de respuestas de células T específicas al gluten. La respuesta inmune adaptativa en la enfermedad celíaca se caracteriza por la respuesta de las células T CD4+ de la mucosa del intestino delgado y los anticuerpos contra la gliadina del trigo y la enzima TG2 (codificada por TGM2) (Fig. 4). En 1997, el descubrimiento de TG2 como un importante autoantígeno permitió una mejor comprensión de la patogénesis de la enfermedad celíaca y el desarrollo de ensayos serológicos muy específicos para el diagnóstico (que se analiza a continuación). Los péptidos nativos del gluten contienen el aminoácido glutamina en las posiciones clave, y estos pueden deamidarse de manera selectiva por TG2. Esta modificación bioquímica hace que los residuos de glutamina se reemplacen por el ácido glutámico, lo que aumenta la afinidad de unión de los péptidos de gluten a las moléculas HLA-DQ2 o HLA-DQ8 en CPA. Los péptidos de gliadina unidos a HLA se presentan además a células auxiliares T CD4+ específicas al gluten.
De manera histórica, las células dendríticas proinflamatorias, que expresan de forma fácil las moléculas HLA-DQ, se consideren como las CPA claves en la enfermedad celíaca. Sin embargo, se propone que las células B específicas a gliadina y específicas a TG2 podrían ejercer funciones similares. Las células T CD4+ específicas al gluten reconocen los péptidos de gliadina presentados por HLA por los receptores de superficie de células T (RCT). De manera interesante, se identifican células T específicas al gluten que llevan un RCT con distintos modos de reconocimiento del epítopo de gliadina sólo en pacientes con enfermedad celiaca. Como los RCT se generan en un proceso aleatorio, los RCT de alta afinidad específicos para la gliadina se pueden producir sólo en una minoría de individuos positivos para HLA-DQ2 o HLA-DQ8, lo que brinda una explicación potencial de por qué la enfermedad celiaca sólo se desarrolla en un subconjunto de estos individuos. Una vez activadas, las células T CD4+ específicas al gluten secretan varias citocinas, incluidas IFNγ e IL-21, y se crea así un medio inflamatorio en la lámina propia del intestino delgado que es propicia para el daño tisular.
Generación de autoanticuerpos. Además de contribuir a la red de citocinas proinflamatorias en el intestino delgado, las células CD4+ específicas al gluten se implican en la generación de las respuestas de anticuerpos que son características de la enfermedad celíaca. Después de encontrar la gliadina unida a HLA en una CPA y activarse, una célula CD4+ podría proporcionar señales de ayuda tanto a las células B específicas al gluten como a las células B específicas a TG2, y promover así su activación y diferenciación en células plasmáticas que secretan anticuerpos contra los péptidos desamidados de gliadina (PDG) y TG2. Ambas poblaciones de anticuerpos pueden detectarse en la circulación de pacientes con enfermedad celíaca; además, los anticuerpos TG2 están presentes en la mucosa del intestino delgado, se depositan en la membrana basal subepitelial y alrededor de los vasos sanguíneos de la mucosa. De forma histórica, se creía que tanto los anticuerpos TG2 en la circulación como los depositados en el intestino se producían en el intestino delgado por células plasmáticas locales. Sin embargo, los datos recientes indican que los anticuerpos TG2 en el suero se secretan por células plasmáticas que están relacionadas de forma clonal a células plasmáticas intestinal específicas a TG2 pero que residen fuera del intestino. De manera independiente de su origen, se propone que tanto los anticuerpos de gliadina como los anticuerpos TG2 desempeñan un papel en la patogénesis de la enfermedad celíaca. Por ejemplo, se piensa que estos anticuerpos aumentan la permeabilidad de la barrera epitelial, y permiten que los péptidos de la gliadina accedan a la lámina propia y afecten la biología de las células epiteliales. De manera interesante, las respuestas de autoanticuerpos dirigidas a otros miembros de la familia de las transglutaminasas se asocian con manifestaciones específicas en la enfermedad celíaca. Los anticuerpos dirigidos a TG3 y TG6, que ocurren en el contexto de la dermatitis herpetiforme y la ataxia por gluten, de forma respectiva, se consideran como contribuyentes potenciales en la patogénesis de estas manifestaciones extraintestinales.
Citocinas en la respuesta inmune de la mucosa intestinal. Un subconjunto de citocinas, incluidas IFNγ e IL-21, producidas por células T CD4+específicas al gluten como resultado de la activación inmunitaria adaptativa, sirven como enlace entre la inmunidad adaptativa y la inmunidad innata. En la enfermedad celíaca, las respuestas inmunes innatas se caracterizan por el aumento de la expresión en la mucosa de IL-15, IL-18 e interferón tipo I, que se cree son producidos por células epiteliales intestinales y/o células dendríticas estresadas. De estas citocinas, se sabe que la IL-15 contribuye al desarrollo de la enfermedad de múltiples maneras−por ejemplo, al inhibir los efectos reguladores de las células T CD4+reguladoras (Treg), para promover así la pérdida de la tolerancia oral y la regulación inmunológica, y permitir a los LIE destruir las células epiteliales intestinales (Fig. 5).
Linfocitos intraepiteliales. Los LIE son una población heterogénea de células T que vigilan la barrera mucosa y pueden ejercer funciones efectoras sin preparación de antígeno específico; interactúan de forma directa con las células epiteliales intestinales y pueden inducir la apoptosis cuando es necesario. En la enfermedad celíaca, el número de LIE aumenta y su cantidad se correlaciona con la gravedad de la atrofia mucosa. Interesante es que los LIE en la mucosa de los pacientes con enfermedad celíaca no se controlan por antígenos dependientes de RCT. En cambio, estas células muestran una transformación citotóxica, que es fundamental para la inducción de la apoptosis de las células epiteliales intestinales impulsada por mecanismos que involucran al ligando de Fas, perforina, granzima B66 y proteína de membrana integral de tipo II NKG2D. Por último, NKG2D, es un receptor activador de los LIE en la superficie y su expresión aumenta en la enfermedad celíaca en respuesta a la IL-15. El principal ligando para NKG2D expresado en las células epiteliales intestinales es una molécula HLA clase I no convencional inducida por estrés, cuya expresión se favorece en la enfermedad celíaca. La interacción de NKG2D y MICA induce de forma directa la muerte de células epiteliales intestinales junto con las vías apoptóticas mencionadas antes. Estos mecanismos contribuyen al desarrollo de la atrofia de las vellosidades de la mucosa del intestino delgado, pero las contribuciones relativas de cada vía en la inducción de la muerte de células epiteliales intestinales en la enfermedad celíaca aún no están claras.
Activación inmune innata. Los investigadores están interesados en comprender los mecanismos anteriores que conducen a la producción desregulada de IL-15 y la activación de la respuesta innata en la enfermedad celíaca; como tal, se proponen muchos candidatos diferentes. Éstos incluyen distintos péptidos del gluten, como el P31-43, que se sugiere induce el estrés de las células epiteliales y eventos proinflamatorios, aunque esto aún es controvertido. Además, las infecciones entéricas, como los patógenos virales y bacterianos (por ejemplo, Campylobacter), podrían inducir de forma directa la liberación de citocinas inmunes innatas y causar estrés de las células epiteliales intestinales o programar características proinflamatorias en las CPA. Además, las proteínas que no contienen gluten, como los inhibidores de la α-amilasa-tripsina (IAT; moléculas endógenas resistentes a las plagas), presentes en el trigo, pueden inducir respuesta inmune innata por medio de mecanismos dependientes del receptor 4 similar a Toll (TLR4). Sin embargo, la relevancia clínica de los IAT en la enfermedad celíaca aún está por determinarse. Por último, la postinfección o los cambios inflamatorios en la microbiota pueden inducir desequilibrios que promueven el estrés de las células epiteliales intestinales y la activación inmune innata. En general, es probable que más de uno de estos factores que actúan mediante diferentes vías estén involucrados en la patogénesis de la enfermedad celíaca.
Factores ambientales
El gluten en la dieta es el factor ambiental más importante involucrado en el desarrollo de la enfermedad celíaca. Sin embargo, la gran mayoría de los humanos se exponen al gluten, y sólo un subconjunto de individuos que portan los alelos de riesgo genético desarrollarán la enfermedad. Por lo tanto, se sugiere que otros factores ambientales podrían estar involucrados. De estos, los microorganismos son objeto de investigaciones recientes.
Microorganismos. En 2004, la microbiota intestinal se relacionó por primera vez con la enfermedad celíaca cuando un estudio describió la presencia de bacterias en forma de bastón asociadas con la mucosa de pacientes con enfermedad celíaca activa o tratada. Un estudio de seguimiento determinó aumento en la cantidad de especies de Clostridium, Prevotella y Actinomyces en pacientes con enfermedad celíaca. De manera más reciente, varios estudios reportaron disbiosis intestinal (es decir, un estado causado por desequilibrio de la microbiota intestinal) en pacientes con enfermedad celíaca y una mayor prevalencia de genes específicos de virulencia microbiana aislados en muestras de pacientes. Además de las bacterias, los virus, como el rotavirus y el reovirus, se implican en la aparición de la enfermedad celíaca. Los resultados obtenidos de estudios in vitro y experimentos con animales realizados con diferentes modelos de ratones relevantes para la enfermedad celíaca apoyan el papel de los microorganismos, como los virus, en la patogénesis de la enfermedad celíaca, pero aún no se demuestra la causalidad directa. La evidencia sugiere que algunos microorganismos (por ejemplo, Helicobacter pylori o citomegalovirus) podrían proteger a las personas del desarrollo de la enfermedad celíaca por medio de mecanismos poco claros. El concepto de que los microorganismos participan en el desarrollo de la enfermedad celíaca también se respalda por estudios epidemiológicos. Por ejemplo, un estudio reciente de cohorte de nacimientos mostró que las infecciones gastrointestinales en general aumentan el riesgo de desarrollar enfermedad celíaca, aunque esto no se verificó en otro estudio prospectivo de cohorte. Un papel indirecto de la disbiosis en la enfermedad celíaca patógena también se aborda en estudios epidemiológicos que se centran en los factores que podrían estar involucrados en la modulación de la microbiota intestinal. Por ejemplo, existen reportes contradictorios sobre las asociaciones de la enfermedad celíaca con el parto por cesárea electiva (que afecta la colonización de la microbiota intestinal infantil), la exposición repetida a antibióticos o la terapia con inhibidores de la bomba de protones. Cabe destacar, sin embargo, que algunos estudios sólo investigan pacientes con diagnóstico clínico de enfermedad celiaca, lo que podría tener un efecto sobre los hallazgos.
Otros factores ambientales. Otros factores ambientales también se implican en el desarrollo de la enfermedad celíaca, como las prácticas de alimentación en la vida temprana. Esta asociación se reconoció por primera vez debido a la epidemia sueca de enfermedad celíaca, que se produjo después de cambios en las prácticas de alimentación infantil en 1984-1996. Durante este período de tiempo, la práctica de alimentación predominante fue posponer la introducción del gluten en la dieta de los 4 a los 6 meses de edad a una edad en que la lactancia a menudo se suspendía. Al mismo tiempo, se incrementó el contenido de gluten de las bebidas de cereales de leche y de las papillas disponibles en el mercado, lo que pudo contribuir a la prevalencia alta de la enfermedad celíaca. Después del reconocimiento de la epidemia, se recomendó a los padres que introduzcan el gluten de forma gradual, y de preferencia mientras todavía se amamanta, y se redujo el contenido de gluten en los alimentos disponibles en el mercado para los lactantes, factores que según la hipótesis contribuyeron a finalizar de la epidemia. Sin embargo, los metanálisis recientes no muestran un efecto de la lactancia materna sobre el riesgo de enfermedad celíaca. Además, según grandes estudios prospectivos, el momento de la introducción del gluten en un grupo de riesgo alto por genética no se asocia con enfermedad celíaca. Las dosis grandes de gluten en la infancia se relacionaron con un riesgo mayor de enfermedad en un estudio; sin embargo, también se reportan hallazgos contradictorios, por lo que se requieren más investigaciones.
Factores ambientales adicionales pueden estar involucrados en la enfermedad celiaca. Fumar, que se implica en la enfermedad inflamatoria intestinal, también se sugiere puede modular el desarrollo de la enfermedad celíaca. Se reporta que el diagnóstico de enfermedad celíaca es menos frecuente en los fumadores que en los no fumadores, pero no está claro si esto se relaciona con la posibilidad de que fumar enmascara las manifestaciones clínicas de la enfermedad celíaca en lugar de prevenirla. En conjunto, el desarrollo de la enfermedad celíaca requiere una interacción compleja entre el huésped, el gluten en la dieta y otros factores ambientales que, en la actualidad, están lejos de ser comprendidos a totalidad.
Diagnóstico, detección y prevención
Signos y síntomas clínicos
La enfermedad celíaca está muy poco diagnosticada, en parte debido a los signos y síntomas clínicos variables (Fig. 6). Con el tiempo, la presentación clínica más común de la enfermedad celíaca pasó de los síntomas de malabsorción en la infancia a manifestaciones multiorgánicas más leves que se presentan tanto en la infancia como en la edad adulta, lo que refleja la naturaleza sistémica de la enfermedad. Los síntomas abdominales aún son comunes, pero los pacientes a menudo experimentan sólo síntomas leves, como deposiciones sueltas, malestar abdominal o flatulencia, o incluso pueden no tener ningún problema gastrointestinal. La mejora en los métodos diagnósticos y el mayor conocimiento clínico de la enfermedad celíaca muy probablemente explican la mayoría de los cambios observados en la presentación clínica de la enfermedad celíaca.
Es importante destacar que los síntomas extraintestinales comprenden una proporción sustancial de las manifestaciones clínicas de la enfermedad celíaca (Fig. 6). La dermatitis herpetiforme, que está presente en hasta 10% de los adultos con enfermedad celíaca, es la manifestación extraintestinal mejor caracterizada y se define por ampollas pruriginosas, sobre todo en los codos, rodillas, glúteos y piel cabelluda. Otras manifestaciones extraintestinales, como artritis, síntomas neurológicos (por ejemplo, neuropatía periférica) y anemia, también son frecuentes. Debido a esta presentación diversa y la falta de conocimiento entre los profesionales de la salud, los retrasos en el diagnóstico pueden alcanzar hasta 10 años en los países ricos en recursos. En entornos con pocos recursos, este retraso puede ser más largo de forma considerable, aunque los datos sobre esto son escasos. Por estas razones, la clave para el diagnóstico de la enfermedad celíaca es un mayor conocimiento del amplio espectro de síntomas. Además, la enfermedad celíaca puede ser asintomática, en cuyo caso los pacientes se pueden encontrar mediante la detección activa en grupos de riesgo (por ejemplo, en los miembros de la familia de los pacientes y en pacientes con trastornos autoinmunes como la diabetes mellitus tipo 1) (Caja 1).
Serología de la enfermedad celíaca
Una combinación de las pruebas de serología de la enfermedad celíaca y la determinación de la morfología de la mucosa del intestino delgado constituyen la base para el diagnóstico de la enfermedad celíaca. Si se sospecha la enfermedad celíaca, varias pruebas serológicas, como los EmAs (anticuerpos específicos para TG2 en el endomisio, que es un tipo de tejido conjuntivo perivascular) y los análisis de anticuerpos TG2, pueden ayudar al proceso del diagnóstico en la selección de pacientes para endoscopia, en los cuales se toman muestras diagnosticas por biopsia duodenal. Los EmAs y los anticuerpos TG2 tienen una sensibilidad excelente (90-100%) y una especificidad cercana a 100% para la enfermedad celíaca. Las pruebas de EmAs se consideran como el método estándar de oro para detectar autoanticuerpos contra la enfermedad celíaca. Sin embargo, como esta prueba se basa en la inmunofluorescencia indirecta, es subjetiva, de rendimiento bajo, laboriosa y costosa. Por el contrario, el ensayo inmunoabsorbente ligado a enzimas (ELISA) independiente del operador y el ensayo de radio fijación para anticuerpos TG2 pueden realizarse en instrumentos automatizados y son más populares en la práctica clínica. Sin embargo, el rendimiento de las pruebas comerciales para anticuerpos TG2 puede variar de acuerdo con la calidad del antígeno TG2 (por ejemplo, la conformación de la molécula) y, como tal, algunas pruebas pueden dar resultados falsos negativos y falsos positivos. En particular, los valores bajos de anticuerpos TG2 a veces se asocian con enfermedades autoinmunes como la diabetes mellitus tipo 1 y en general las enfermedades infecciosas. Los ensayos de anticuerpos antigliadina de primera generación, que utilizan péptidos nativos de gliadina como antígeno, se consideran inexactos y, como tales, ya no se recomiendan para el diagnóstico de la enfermedad celíaca. Las pruebas más recientes desarrolladas utilizan PDG como antígenosp0 91 para detectar anticuerpos específicos para PDG; estas pruebas pueden reconocer a algunos pacientes con enfermedad celíaca que no se detectan con las pruebas establecidas de EmAs y anticuerpos TG2. Sin embargo, las pruebas de anticuerpos para PDG aún no son de uso común en la práctica clínica. En particular, las pruebas serológicas más precisas para la enfermedad celíaca son para el isotipo IgA, EmA y anticuerpos TG2, y solo en el caso de deficiencia selectiva de IgA se necesitan pruebas de anticuerpos de isotipo IgG. Además ~10% de los pacientes con la enfermedad son seronegativos y, por lo tanto, no pueden identificarse por ninguno de los métodos serológicos actuales. En casos seronegativos, el diagnóstico se basa en la detección de daño en la mucosa del intestino delgado que al igual que los síntomas, responde a la dieta sin gluten.
En la actualidad, existen varias pruebas comerciales rápidas en puntos de atención disponibles para la detección de anti-PDGs y anticuerpos TG2. Estas pruebas ofrecen resultados inmediatos en un entorno de atención primaria y podrían ser un recurso útil en entornos de personal de atención de salud y con recursos limitados de laboratorio. Sin embargo, los datos sobre el rendimiento de estas pruebas rápidas todavía son limitados, y se necesitan más estudios antes de recomendar el uso de estas pruebas en la práctica clínica diaria.
Biopsia del intestino delgado
En los individuos que son seropositivos para autoanticuerpos específicos de la enfermedad celíaca o cuando la sospecha clínica de la enfermedad es alta debido a los síntomas, se implementan los procedimientos de diagnóstico adicionales. El diagnóstico de la enfermedad se basa de manera histórica en la demostración de atrofia de las vellosidades de la mucosa del intestino delgado, linfocitosis intraepitelial e hiperplasia de las criptas en las muestras de biopsia obtenidas por gastroscopía. Sin embargo, hay varios retos en el método de diagnóstico basado en biopsia. En primer lugar, puede producirse una atrofia de las vellosidades comparable con el tratamiento con ciertos medicamentos, infecciones virales y bacterianas y como consecuencia de la enteropatía autoinmune (Caja 2). Como tal, la atrofia de las vellosidades per se no es un hallazgo patognomónico específico para la enfermedad celíaca. Segundo, en el contexto de la enfermedad celíaca, la atrofia de las vellosidades es la etapa final de la destrucción gradual de las vellosidades intestinales y puede tomar años o incluso décadas para desarrollarse (Fig. 7). Sin embargo, los pacientes pueden mostrar ya varios síntomas antes del desarrollo de la lesión intestinal evidente. Además, los pacientes muestran beneficio de una dieta libre de gluten incluso en una fase temprana en el desarrollo de la enfermedad, lo cual apoya el concepto de que la enfermedad celíaca se extiende más allá de la atrofia de las vellosidades. Esta condición con anticuerpos séricos específicos positivos para la enfermedad celíaca, pero morfología normal de la mucosa del intestino delgado suele denominarse enfermedad celíaca potencial. No existe un consenso si todos los casos, en especial los asintomáticos, deberían tratarse con una dieta libre de gluten o monitoreo continuo durante el consumo de gluten. En tercer lugar, el daño a la mucosa en la enfermedad celíaca puede ser irregular y por lo tanto, sólo detectable en áreas específicas del intestino delgado (por ejemplo, el bulbo duodenal). Sin embargo, la determinación de la morfología intestinal en muestras de biopsia del bulbo es aún más difícil, las muestras de biopsia a menudo son de mala calidad y pueden tener muchas glándulas de Brunner, que son glándulas racemosas en la capa del duodeno que secretan moco alcalino y una potente enzima proteolítica. Independiente del lugar de la biopsia, la interpretación de la histología de la mucosa se debe realizar con alta calidad, bien orientada y cortar de forma correcta las muestras para evitar errores de clasificación y diagnósticos erróneos.
Herramientas adicionales de diagnóstico
En casos de problemas de diagnóstico, como pacientes seronegativos o pacientes con daño en el borde de las vellosidades, son necesarias herramientas adicionales no convencionales para identificar de forma confiable a los pacientes con enfermedad celíaca. La tipificación de HLA es útil para la exclusión de la enfermedad celíaca, ya que es muy poco probable que surja el trastorno en individuos que no tienen HLA-DQ2 o HLA-DQ8. La cuantificación de células inflamatorias en la mucosa del intestino delgado también puede proporcionar información útil para el diagnóstico. Aunque un número mayor de linfocitos CD3+ en la mucosa del intestino delgado por sí solo no es un hallazgo específico para la enfermedad celíaca, la determinación de un número mayor de estas células a partir de los extremos de las vellosidades o la cuantificación de LIE positivos- γδ puede tener un valor adicional en casos limitados. Además, la detección de los depósitos de autoanticuerpos isotipos IgA celíacos dirigidos a TG2 en muestras de tejido de la mucosa intestinal es útil en casos inequívocos, pero requiere muestras de biopsia congelada. La presencia de células T específicas al gluten en la circulación puede proporcionar un medio potencial para el diagnóstico, incluso en los casos en que un individuo redujo su ingesta de gluten en la dieta. Un reto de 3 días de gluten induce la movilización de las células T de memoria reactivas contra la gliadina, que se puede detectar mediante ensayo de inmunoadsorción de IFNγ ligado a enzima (ELISPOT). Sin embargo, aunque el ensayo es muy específico para la enfermedad celíaca, no es capaz de identificar a todos los pacientes. De forma alternativa, se puede usar la citometría de flujo, con tetrámeros HLA-DQ-gluten. La tecnología es capaz de identificar a los pacientes con enfermedad celíaca con un nivel alto de precisión, de manera independiente si los individuos están en una dieta libre de gluten. Hasta ahora, las únicas herramientas adicionales utilizadas fuera de un entorno de investigación son la tipificación de HLA y la inmunohistoquímica para los subconjuntos de LIE y a veces los depósitos de IgA intestinal.
Sensibilidad no celíaca al gluten
Los síntomas de la enfermedad celíaca están lejos de ser específicos de la enfermedad, y los pacientes con, por ejemplo, el síndrome del intestino irritable o alergia a los cereales pueden presentar síntomas abdominales similares. De manera interesante, hace tiempo se sabe que una gran cantidad de pacientes que experimentan síntomas gastrointestinales funcionales se benefician al evitar el trigo incluso en ausencia de enfermedad celiaca. Estudios aleatorizados recientes indican que algunos pacientes que presentan síntomas a los cereales que contienen gluten tienen una verdadera sensibilidad no celíaca al gluten (SNCG). La prevalencia de SNCG es probable que supere la de la enfermedad celíaca, ya que se estima que afecta ~2 a 5% de los individuos de la población general. En la actualidad, no existe un biomarcador confiable para SNCG, y el diagnóstico de SNCG requiere la exclusión cuidadosa de la enfermedad celíaca. Los pacientes con SNCG tienen una morfología normal de la mucosa del intestino delgado y son seronegativos para los autoanticuerpos celíacos. La dependencia de los síntomas al gluten debe demostrarse mediante el reto doble ciego al gluten, lo que hace que el proceso del diagnóstico sea laborioso. De manera interesante, estudios recientes indican que la SNCG podría asociarse con otros desencadenantes además del gluten (por ejemplo, los fructanos podrían estar involucrados).
Prevención
Como ya se indicó, la incidencia y la prevalencia de la enfermedad celíaca van en aumento con el tiempo y la enfermedad causa una considerable carga de salud para los individuos y para la sociedad. La enfermedad celíaca se puede considerar como un problema de salud pública, ya que aumenta el riesgo de mortalidad general, reduce la QOL y produce consecuencias económicas negativas extensas. Una vez diagnosticada y tratada con una dieta libre de gluten, el estado de salud del paciente mejora; sin embargo, prevenir la aparición de la enfermedad celiaca en su totalidad sería aún más beneficioso.
La mejor estrategia posible de prevención primaria estudiada se deriva de los datos presentados en un estudio epidemiológico sueco de la enfermedad celíaca a mediados de los años ochenta. Este estudio sugiere que la enfermedad celíaca se puede prevenir por la introducción temprana de cantidades pequeñas de gluten en la dieta de los niños pequeños, en particular mientras se amamantan. Sin embargo, dos estudios de intervención aleatorizados controlados que analizaron el momento de introducción del gluten en la dieta de niños pequeños de familias con enfermedad celíaca y tres estudios observacionales prospectivos mostraron que estas prácticas de ablactación temprana no prevenían la enfermedad celíaca. Además, dos revisiones sistemáticas y metaanálisis concluyeron que el momento de introducción del gluten y la duración del mantenimiento de la alimentación al seno materno no influyen en el desarrollo de la enfermedad celíaca. Los datos de la cohorte Determinantes Ambientales de Diabetes en los Jóvenes (TEDDY) indican que una ingesta elevada (>5.0 g por día) de gluten durante los primeros 2 años de la vida se asoció con un riesgo incrementado de enfermedad celíaca en niños suecos. Sin embargo, un análisis similar de los datos en el estudio internaciones PREVENTCD mostró que la cantidad consumida de gluten a los 11-36 meses no influyó en el riesgo de desarrollar enfermedad celíaca. Por lo tanto, este tópico queda abierta para evaluación posterior.
Las infecciones intestinales en la vida temprana se asocian con el desarrollo de la enfermedad celíaca, pero el tema de las infecciones es controvertido: algunos estudios prospectivos demuestran una asociación entre las infecciones en la vida temprana y el riesgo de enfermedad celíaca, mientras que otros no. Además, se publicaron hallazgos discrepantes sobre el modo de nacimiento (parto vaginal versus cesárea) y el riesgo de enfermedad celíaca. En conjunto, ninguna de las estrategias principales para la prevención de la enfermedad celíaca demuestran prevenir la enfermedad, y en la actualidad el diagnóstico y el tratamiento tempranos son la única forma de lograr una prevención secundaria al detener la progresión de la enfermedad y la aparición de síntomas. Hay dos enfoques para lograrlo esto−detección o búsqueda de casos.
Estrategias de detección
La mayoría de las guías nacionales e internacionales sobre la enfermedad celíaca recomiendan la detección en grupos de riesgo alto, como los familiares de primer grado de los pacientes con enfermedad celíaca y aquellos con trastornos asociados de riesgo alto (Caja 1) para aumentar la tasa de diagnóstico. La búsqueda activa de casos se refiere a pruebas serológicas de umbral bajo seguidas de una biopsia confirmatoria para casos seropositivos. Dichas pruebas en pacientes con síntomas diversos asociados a enfermedad celiaca conducen al diagnóstico temprano de un gran número de pacientes con enfermedad celíaca. Sin embargo, esta estrategia no identificará a todos los pacientes; así, que se sugiere el cribado masivo por serología en la población general. En principio, la enfermedad celíaca cumple con los criterios de la OMS para la detección masiva ya que es un problema de salud importante, existe un tratamiento aceptado, existen instalaciones disponibles para el diagnóstico y el tratamiento, existe una etapa sintomática latente o temprana reconocible y existe una prueba adecuada para detectar la enfermedad. Además, los proyectos de investigación de cribado masivo de la enfermedad celíaca en Europa y los Estados Unidos muestran que el cribado es bien aceptado por la población general. Además, la historia natural de la enfermedad, desde las fases tempranas del desarrollo de la enfermedad hasta la fase latente y la enfermedad sintomática manifiesta con atrofia de vellosidades, es cada vez más comprendida por investigadores y profesionales de la salud. También existe evidencia de mejoras en la salud por tratamiento temprano en individuos asintomáticos. Sin embargo, todavía hay pocos datos sobre las complicaciones que pueden surgir de la enfermedad celíaca no diagnosticada y no tratada. Además, se necesitan datos adicionales sobre la eficacia en función de los costos de la detección masiva en la población general. En 2017, un grupo de trabajo de servicios preventivos de EE. UU revisó la evidencia de la detección masiva de la enfermedad celíaca y concluyó que se necesita más investigación para comprender la efectividad de la detección y el tratamiento de la enfermedad celíaca, la precisión de las pruebas de detección en individuos asintomáticos y las estrategias óptimas.
Tratamiento
Dieta sin gluten
El pilar del tratamiento para la enfermedad celíaca es el cumplimiento estricto de por vida de una dieta sin gluten. La dieta libre de gluten es la terapia documentada para la enfermedad celíaca desde justo después de la Segunda Guerra Mundial. Persiste como uno de los muy pocos tratamientos causales en medicina, con excelentes resultados en general. El término dieta libre de gluten se usa para una dieta desprovista de péptidos perjudiciales del gluten; en la práctica, esto significa evitar todos los alimentos basados o que contienen trigo, cebada, centeno y todas las variedades que cruzan de estos cereales. Las variedades primitivas del trigo como kamut, einkorn y otras pueden ser menos tóxicas para pacientes con enfermedad celíaca; pero esto no se demostró de forma convincente en estudios apropiados. La espelta es una variedad de trigo que se cree por muchos que sea un trigo “primitivo”, pero esto no es cierto en la actualidad ya que contiene muchas de las secuencias tóxicas de péptidos y los pacientes deben por lo tanto evitarla. Así como el trigo es la base de la mayoría de los alimentos basados en granos, como el pan, la pasta, los pasteles y muchos bocadillos, y se usa a menudo para espesar salsas y como un aditivo para estabilizar, saborizante y otras funciones, evitarlo por completo es muy difícil.
Aunque una dieta estricta libre de gluten es vital para los pacientes con enfermedad celíaca, los estudios sugieren que la composición nutricional de esa dieta podría no ser ideal. Como tal, una dieta libre de gluten debe tener siempre motivos médicos. Una dieta libre de gluten a menudo se asocia con una ingesta más alta de carbohidratos y más baja en fibra y minerales. Además, la evitación del gluten puede resultar en el consumo reducido de granos enteros benéficos (benéficos para la salud cardiovascular), lo cual puede incrementar el riesgo cardiovascular. Incluso si la popularidad de las dietas libres de gluten se incrementó de forma considerable entre la población general durante los años recientes, debido a las razones mencionadas antes, no se debe recomendar la promoción de una dieta libre de gluten entre personas sin enfermedad celíaca.
Estándares para los productos libres de gluten. La legislación de los productos libres de gluten se basa el estándar del Codex Alimentarius de la OMS. De acuerdo con estas guías, la Comisión Europea en 2012 y la FDA de los EE. UU en 2013 emitieron regulaciones que definen los alimentos etiquetados como “libres de gluten” aquellos que contienen <20 partes por millón (ppm) de gluten (equivalente a 20 mg por kg de alimento) cuando se miden mediante un sistema aprobado para pruebas. Muchos pacientes con enfermedad celíaca se favorecen de productos sin gluten a base de almidón de trigo, que pueden contener cantidades mínimas de gluten residual. Estudios previos aleatorizados y de seguimiento a largo plazo muestran que estos productos son seguros y bien tolerados en la mayoría de los pacientes. En 2018, los productos sin gluten en la industria a base de harina de trigo purificada de forma industrial contienen <20 ppm de gluten y, por lo tanto, se permiten de forma amplia para pacientes con enfermedad celíaca, en particular en el norte de Europa y el Reino Unido. Por el contrario, Australia y Nueva Zelanda tienen reglas más estrictas que no permiten el gluten en productos sin gluten.. Una dieta con cero gluten sería ideal; sin embargo, en el mundo real, tal dieta es imposible de lograr y los métodos analíticos podrían no estar disponibles para evaluar los productos.
Para cumplir con los requisitos de las regulaciones para alimentos libres de gluten y para garantizar un etiquetado preciso de los alimentos, en la actualidad se utiliza un análisis de gluten ELISA R5 (Mendez) como el estándar de oro oficial para medir el nivel de gluten en los alimentos. El ensayo reconoce un pentapéptido (QQPFP) y las secuencias homólogas que ocurren de forma repetida en las prolaminas del trigo, el centeno y la cebada. Sin embargo, la prueba tiene algunas limitaciones importantes, ya que no detecta la contaminación de cebada en productos de avena, gluteninas de trigo de peso molecular alto y péptidos hidrolizados de gluten. Como tal, en la actualidad se desarrollan pruebas más precisas para detectar la contaminación por gluten en los alimentos.
Fallas dietéticas. En la enfermedad celíaca, la adherencia a la dieta es esencial para lograr la curación de la mucosa del intestino delgado y el alivio de los síntomas. La adhesión a una dieta libre de gluten depende de un nivel alto de conocimiento y motivación en los pacientes. Sin embargo, como antes se mencionó, una dieta completa sin gluten es difícil e imposible de mantener. Sobre la base de datos limitados de unas pocas series pequeñas de pacientes, parece que existe una gran variación en la sensibilidad al gluten entre los pacientes con enfermedad celíaca. Sin embargo, una ingesta diaria de 10 a 20 mg de gluten parece inofensiva, mientras que el consumo diario de >200 a 500 mg parece inducir daño e inflamación de las vellosidades del intestino delgado. En contraste, la dieta occidental estándar contiene 10-20 g de gluten por día.
Aunque ahora hay disponible una variedad de productos buenos, muchas personas encuentran que la dieta sin gluten es menos apetecible que una dieta regular. Los productos sin gluten también suelen ser más caros y están mal etiquetados, lo que dificulta el cumplimiento estricto de la dieta de por vida y predispone a lapsos dietéticos. De acuerdo con esto, una proporción considerable de pacientes con enfermedad celíaca reportan lapsos dietéticas anunciados, y la proporción de pacientes que reportan adherirse a una dieta estricta oscila entre 42% y 96%. Los factores posibles que se pueden asociar con una mala adherencia incluyen el diagnóstico en la adolescencia, el nivel socioeconómico más bajo, la cultura alimentaria local y los viajes y las comidas en restaurantes. Además, aquellos pacientes sin síntomas pueden ser más propensos a la ingesta ocasional de gluten.
De manera interesante, varios estudios muestran una normalización histológica incompleta de la mucosa del intestino delgado a pesar de que los pacientes se adhieren a una dieta estricta sin gluten, lo que sugiere una ingesta inadvertida de gluten. Por lo tanto, la industria alimentaria y los legisladores tienen la responsabilidad de prestar atención especial para garantizar la pureza de los productos sin gluten. Además, se recomienda a los pacientes que sean cautelosos con su selección de alimentos y que eviten todas las fuentes de posible contaminación por gluten. Para lograr esto, todos los individuos que participan en la cocina libre de gluten necesitan conocimientos, como los miembros de la familia sin enfermedad celíaca y los chefs y los proveedores de comida en los restaurantes, las escuelas y los lugares de trabajo. En general, debido a los retos en la dieta sin gluten, una parte considerable de los pacientes con enfermedad celíaca afirman que estarían dispuestos a tomar un medicamento o algún tipo de vacuna o inmunoterapia en lugar de adherirse a una dieta sin gluten.
La avena en la dieta sin gluten. Si bien la avena contiene menos de 20 ppm de gluten y cumple con el estándar del Codex Alimentarius para productos sin gluten, la inclusión de la avena en una dieta sin gluten es un tema controvertido. Las ventajas potenciales de incorporar avena en la dieta libre de gluten se relacionan con varios beneficios nutricionales, como contribuir con una fuente de fibra soluble, minerales y vitaminas, así como reducir la glucemia postprandial y los niveles de lipoproteínas de densidad baja. Además, la adición de avena diversificaría la dieta restrictiva. La evidencia amplia muestra que la avena es bien tolerada por la mayoría de los pacientes con enfermedad celíaca y no tiene efectos perjudiciales sobre la morfología de la mucosa del intestino delgado o los síntomas clínicos, incluso después del consumo a largo plazo. Sin embargo, también existen resultados controvertidos que indican que, en algunos pacientes, el consumo de avena puede desencadenar síntomas clínicos, inducir inflamación de la mucosa y dificultar la normalización de la respuesta inmunitaria intestinal. Además, en modelos experimentales de enfermedad celíaca, la avena muestra respuestas biológicas con posibles diferencias en los efectos tóxicos entre las diferentes variedades de avena. Debido a estos resultados discrepantes, junto con el temor a la contaminación de los productos de avena con otros cereales que contienen gluten, la avena se restringe en la dieta libre de gluten. En la actualidad, la inclusión de la avena en la dieta libre de gluten varía entre los diferentes países; por ejemplo, la avena se acepta en Escandinavia, el Reino Unido, los Estados Unidos y Canadá, pero no se recomienda en Australia y Nueva Zelanda. Es evidente que estos temas requieren una mayor aclaración, junto con una mayor investigación sobre las posibles diferencias en la tolerancia a la avena entre individuos y poblaciones en cuanto a la genética diferentes. En conjunto, aunque la mayor parte de la evidencia actual apoya la seguridad clínica de la avena en la enfermedad celíaca, se necesitan estudios prospectivos de calidad más alta.
Seguimiento del paciente
El seguimiento en la enfermedad celíaca se considera importante para confirmar la respuesta y la adherencia a una dieta sin gluten y para detectar posibles complicaciones. Sin embargo, la evidencia científica actual sobre la implementación óptima y la frecuencia de seguimiento del paciente con enfermedad celíaca es limitada. No está claro quién será responsable del seguimiento de los pacientes y si el seguimiento debería ser más personalizado. Debido a esta ambigüedad, existe una variación dentro de las guías actuales. Sin embargo, de acuerdo con todas las guías, se recomienda la evaluación clínica y dietética y las pruebas serológicas, a menudo de forma anual o bianual. Las pruebas positivas de detección de anticuerpos séricos en el seguimiento a menudo indican una mala adherencia en la dieta y un daño continuo en la mucosa del intestino delgado; sin embargo, las pruebas negativas para anticuerpos celíacos durante una dieta libre de gluten no siempre significan una recuperación histológica adecuada. Aunque una biopsia repetida durante una dieta libre de gluten es en la actualidad la única herramienta confiable para demostrar la curación de la mucosa del intestino delgado, no hay consenso sobre el uso rutinario de la biopsia en adultos, y la biopsia de seguimiento no se realiza en los niños. Además, la interpretación de las muestras de biopsia del intestino delgado es desafiante, como ya se explicó antes. En los niños, la demostración de la respuesta clínica y serológica es suficiente, junto con el monitoreo continuo del crecimiento y desarrollo. Además, el seguimiento debe asegurar que las posibles deficiencias nutricionales (por ejemplo, hierro, ácido fólico y vitamina B12) presentes en el momento del diagnóstico de la enfermedad celíaca se hayan corregido, aunque la necesidad de monitorear de forma rutinaria estos parámetros podría ser no necesaria. En pacientes con una respuesta inadecuada a una dieta libre de gluten, una evaluación cuidadosa realizada por un nutricionista clínico es de suma importancia.
Enfermedad celíaca refractaria
Los efectos clínicos de una dieta sin gluten son, en la mayoría de los casos, rápidos y convincentes, pero la recuperación de la morfología de la mucosa intestinal puede llevar meses o incluso años. Sin embargo, en algunos pacientes, la mucosa no se cura, y en casos aún más raros, un paciente puede desarrollar atrofia de las vellosidades después de una mejoría clínica y morfológica inicial. En estas circunstancias, debe considerarse la enfermedad celíaca refractaria (ECR). La ECR se define por la atrofia persistente o recurrente de las vellosidades y los síntomas de malabsorción a pesar de la adherencia a una dieta estricta sin gluten. Es posible que algunos pacientes con ECR nunca respondieron a una dieta sin gluten (ECR primaria) o recayeron a pesar de la adherencia y la respuesta inicial a la dieta sin gluten (ECR secundaria). Si se sospecha de ECR, debe reconsiderarse el diagnóstico original de enfermedad celíaca. Además de la ingesta involuntaria o advertida de gluten, deben excluirse otras causas de atrofia de las vellosidades antes de poder establecer el diagnóstico de ECR. Según estudios recientes basados en la población, la ECR afecta a0.3% de los pacientes con enfermedad celiaca diagnosticada y su prevalencia en la población general es 0.002%. La ECR es un trastorno grave con el potencial de convertirse en yeyunitis ulcerativa y además en linfoma de células T asociado a enteropatía. Los síntomas a menudo son graves y requieren una intervención terapéutica adicional además de una dieta libre de gluten. La condición se puede subdividir en tipo I (ECRI) y tipo II (ECRII), éste último se caracteriza por una acumulación masiva de LIE anormales que expresan CD3ε citoplasmáticos pero que carecen de la expresión de los marcadores de superficie de células T CD3, CD4 y CD8 o que contienen reordenación o reordenamientos de células T clonales. Además, la ECRII no responde a ningún tratamiento y tiene un pronóstico desfavorable. Varios factores que predisponen al desarrollo posterior de ECR identifican e incluyen la edad avanzada, los síntomas de malabsorción y seronegatividad en el momento del diagnóstico de la enfermedad celíaca, así como un historial de mala adherencia dietética. En la enfermedad celíaca, la atrofia persistente de las vellosidades también puede ocurrir en ausencia de síntomas clínicos, y esta condición es más común que la ECR, que afecta a 4 a 79% de los pacientes con enfermedad celíaca. Sin embargo, incluso en ausencia de síntomas, el pronóstico del trastorno no es ideal, y estos los individuos pueden estar predispuestos a complicaciones graves, como osteoporosis y tumores malignos.
Síntomas sin atrofia de las vellosidades en la dieta
Alrededor de 20 a 50% de los pacientes con la enfermedad tiene síntomas persistentes o recurrentes a pesar de una dieta a largo plazo sin gluten. Sólo una pequeña parte de los síntomas en estos pacientes se explican por ECR, pero su exclusión es obligatoria. La morfología de la mucosa del intestino delgado es en realidad normal. La intolerancia a la lactosa y las afecciones autoinmunes se relacionan con la enfermedad celíaca (Tabla 3, Caja 1). De manera interesante, los pacientes que experimentan síntomas graves antes del diagnóstico o aquellos con un retraso prolongado en el diagnóstico son propensos en particular a síntomas persistentes durante una dieta libre de gluten. Además, la composición microbiana intestinal y la ingesta baja en fibra pueden desempeñar un papel en la mala respuesta de los síntomas. En conjunto, el tratamiento dietético sin gluten no siempre es suficiente por sí mismo y deben considerarse enfoques terapéuticos suplementarios individualizados.
Pronóstico
El pronóstico de la enfermedad celíaca fue un tema de investigación y debate durante décadas. Todos los médicos que trabajan con estos pacientes ven de forma regular que la gran mayoría de los pacientes experimentan una vida muy buena y larga después de que se establece el diagnóstico de la enfermedad celíaca. En contraste, un subgrupo de pacientes desarrolla complicaciones como el cáncer. Además del linfoma de células T asociado a enteropatía, la enfermedad celíaca se asocia con un aumento en otros tipos de linfoma no Hodgkin y adenocarcinoma del intestino. Sin embargo, por razones poco claras, el cáncer de mama se observa con menos frecuencia en mujeres con enfermedad celíaca. Es importante destacar que los tipos de cáncer antes mencionados que tienen una mayor prevalencia en pacientes con enfermedad celíaca también rara vez se encuentran en la población general.
Una complicación no neoplásica de la enfermedad celíaca es la hipofunción esplénica, que podría predisponer a los pacientes a un mayor número de infecciones. Sin embargo, el hipoesplenismo a menudo se asocia con formas más graves de la enfermedad celíaca (por ejemplo, ECR), pero los estudios sobre este tema son limitados en número.
Una asociación entre la enfermedad celíaca y el aumento de la mortalidad está bien documentada. Estudios de registro epidemiológico muy grandes de Suecia sugieren una mayor mortalidad, pero sólo tan baja como 1.4 veces la de la población general, lo que indica que la mortalidad sólo aumenta de manera ligera en individuos con enfermedad celíaca. El mayor riesgo de muerte se debió de forma específica a las enfermedades cardiovasculares y respiratorias, así como al cáncer. Sin embargo, un estudio poblacional reciente en el Reino Unido sugirió que los pacientes con enfermedad celíaca diagnosticados cerca o después del año 2000 no tienen un riesgo excesivo de mortalidad, aunque aún existe un riesgo excesivo de 0.15% de morir por linfoma no Hodgkin.
Con todo, las complicaciones de la enfermedad celíaca son impredecibles. Los clínicos no tienen herramientas para predecir qué pacientes con enfermedad celíaca desarrollarán complicaciones; por lo tanto, el consejo clínico a los pacientes siempre será adherirse a una estricta dieta.
Calidad de vida
Similar a otros trastornos crónicos, la enfermedad celíaca es una condición desafiante que afecta la calidad de vida de los pacientes, así como la de los padres y cuidadores. En el trascurso de la historia, se utilizaron escalas no específicas para medir la calidad de vida en la enfermedad celíaca, pero desde 2007, se desarrollaron varios cuestionarios específicos para niños y adultos.
En el momento del diagnóstico, los pacientes sintomáticos a menudo reportan una QOL más baja que las poblaciones de control. La dieta sin gluten puede imponer restricciones sociales, pero en general, se demuestra que la calidad de vida mejora en la mayoría de los pacientes con enfermedad celíaca cuando se inicia una dieta sin gluten.. El factor más evidente que mejora la calidad de vida es el alivio de los síntomas. Sin embargo, existe evidencia de que, en comparación con la población en general, la calidad de vida persiste peor en muchas personas con enfermedad celíaca tratada, en particular las mujeres. Cabe destacar que en el momento del diagnóstico, la calidad de vida de los pacientes diagnosticados mediante detecciónserológica y pacientes asintomáticos puede ser superior a la de los pacientes con síntomas. Es importante destacar que en individuos asintomáticos, el tratamiento dietético pesado no afecta la calidad de vida; en cambio, muchos estudios sugieren efectos beneficiosos. Al interpretar la calidad de vida es importante tener en cuenta que la calidad de vida depende de los aspectos ambientales y culturales; por lo tanto, los resultados pueden no ser siempre aplicables para diferentes poblaciones.
Encontrar una forma para mejorar la calidad de vida en la enfermedad celíaca es un desafío. El tratamiento de la enfermedad implica un esfuerzo activo del paciente para regular los sentimientos, acciones y reacciones durante cualquier actividad social que involucre alimentos. Se investigaron estrategias de tratamiento para aumentar la calidad de vida, por ejemplo, mediante el control del locus (El control del locus es un concepto sicológico que se refiere a la medida en que una persona cree que sus propias acciones influyen en los eventos en el entorno), que favorece el “control primario” (por ejemplo, los pacientes pueden llevar su propia comida libre de gluten a los eventos sociales) y desalienta el “afrontamiento pasivo o de desconexión” (por ejemplo, la negación de la presencia de la enfermedad). Además, una herramienta adicional para mejorar el tratamiento de la enfermedad podría ser la consulta en línea para niños y adultos jóvenes. A pesar de estas herramientas, muchas personas con enfermedad celíaca tratan su enfermedad con poco apoyo de los prestadores de atención médica. Aunque muchos pacientes con enfermedad celíaca se adaptan de forma eventual a su enfermedad con el tiempo, parece que todavía existe una gran necesidad de capacitación de profesionales de la salud y trabajadores de la industria alimentaria para mejorar la calidad de vida de los pacientes.
Perspectivas
Patogenia de la enfermedad celíaca
Se lograron avances sustanciales en la comprensión de la patogenia de la enfermedad celíaca. En la actualidad, la respuesta inmunitaria impulsada por el gluten en la dieta que se produce en la mucosa del intestino delgado está bien caracterizada, y se establece el papel de HLA-DQ2 y/o HLA-DQ8 y el autoantígeno TG2 de la enfermedad celíaca en estos procesos. Debido a esto y al conocimiento de que la exclusión del gluten de la dieta revierte la patología, la enfermedad celíaca puede considerarse un modelo para estudiar los mecanismos implicados en otros trastornos autoinmunes. La evidencia sugiere que otros factores ambientales además del gluten, como la microbiota intestinal y las infecciones, pueden determinar la respuesta inmune del huésped al gluten; sin embargo, las relaciones detalladas de causa y efecto y la interacción precisa entre la genética del huésped, la nutrición y la microbiota aún no están claras. Es probable que en el futuro se desarrollen nuevos modelos animales que permitan la investigación de la sensibilidad al gluten, el tipo HLA de la enfermedad celíaca, los autoanticuerpos específicos de la enfermedad y las respuestas inmunitarias adaptativa e innata inducidas por el gluten, que puedan permitir una visión más profunda de la patogenia de la enfermedad. Los mecanismos de las manifestaciones extraintestinales de la enfermedad celíaca son desconocidos y en las actualidad especulativos; por lo tanto, se necesita más trabajo para descubrirlos en el futuro.
Diagnóstico
El diagnóstico clínico de la enfermedad celíaca avanza hacia procedimientos no invasivos; por ejemplo, en un subgrupo de niños, el diagnóstico se puede establecer sin la necesidad de una biopsia de intestino delgado. En 2012, la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátricas (ESPGHAN) sugirió que en niños sintomáticos que tienen niveles séricos altos de anticuerpos TG2 (≥10 × límite superior de lo normal) en dos mediciones independientes, junto con seropositividad para EmAs y haplotipos HLA celíacos asociados, el diagnóstico de la enfermedad celíaca se puede establecer sin biopsias tomadas por endoscopia invasiva. La evaluación prospectiva de estos criterios diagnósticos de ESPGHAN muestra que tienen un valor predictivo positivo de 99.7% para la enfermedad celíaca en este grupo de niños. Sin embargo, la inclusión del análisis de haplotipos HLA no aumentó la precisión del diagnóstico, y las guías de ESPGHAN están en reevaluación en la actualidad. El rendimiento de estas guías no se evaluó lo suficiente en todos los subgrupos de pacientes; por lo tanto, se necesitan más estudios prospectivos para aclarar si se puede adoptar un enfoque no invasivo similar para adultos y personas asintomáticas.
La incorporación de datos genéticos diferentes a HLA en el estudio de diagnóstico es un escenario futuro interesante. Por ejemplo, el genotipo HLA y algunas otras docenas de variantes genéticas podrían proporcionar un medio útil y rentable para definir a aquellos en riesgo de desarrollar enfermedad celíaca y ser un paso hacia la medicina personalizada. Además, el análisis del tetrámero HLA-DQ-gluten en sangre podría ser útil en el futuro como una herramienta de diagnóstico, para permitir a las personas con sospecha de enfermedad celíaca evitar la exposición al gluten y la biopsia duodenal. La determinación de la morfología de la mucosa del intestino delgado a partir de muestras de biopsia obtenidas en la endoscopia es probable que todavía será necesaria en casos problemáticos. Sin embargo, serían bienvenidos métodos alternativos para complementar o incluso reemplazar la histología convencional.
Tratamiento
Una dieta estricta sin gluten fue el único tratamiento eficaz para la enfermedad celíaca durante muchos años, y debido a la eficacia, seguridad y precio bajo, es probable que esta dieta persista como importante en el tratamiento de la enfermedad en el futuro. Las tecnologías mejoradas para la detección de gluten en los alimentos y para controlar la exposición reciente al gluten (por ejemplo, la detección de gluten en la orina mediante una técnica de flujo lateral cuantitativo) permitirán a la industria alimentaria proporcionar un suministro de alimentos más seguro y más amplio para los pacientes con enfermedad celíaca. De manera desafortunada, algunos pacientes no responden a una dieta sin gluten, e incluso los pacientes receptivos expresan el deseo de terapias alternativas debido a la naturaleza restrictiva de la dieta. Aunque hasta ahora no se aprobaron medicamentos para la enfermedad celíaca, varios proyectos están en investigación. Estos incluyen medicamentos que tienen como objetivo corregir el daño de la barrera intestinal (también llamado intestino permeable) (acetato de larazotida); píldoras de enzimas que digieren el gluten durante y después de la ingesta (latiglutenasa); medicamentos que inhiben la modificación química del gluten por TG2 en la mucosa (ZED1227); y anticuerpos monoclonales dirigidos a IL-15, que tienen como objetivo bloquear el permiso de LIE para matar células epiteliales (AMG 714). Dos fármacos, el acetato de larazotida y la latiglutenasa, progresan a lo largo de los estudios clínicos de fase II, que muestran que el acetato de larazotida fue eficaz para reducir los síntomas desencadenados por el gluten y la latiglutenasa atenúa el daño inducido por el gluten. Además de los medicamentos, se desarrolla una vacuna (Nexvax2) que consta de epítopos para las células Treg específicas al gluten para inducir tolerancia inmune y en la actualidad completaron ensayos clínicos fase I.
A medida que los nuevos fármacos avanzan hacia ensayos clínicos de fase II, serían útiles marcadores sustitutos no invasivos para el daño del intestino delgado inducido por el gluten y medidas de resultado efectivas relacionadas con el paciente. Dichos marcadores sustitutos no invasivos incluyen, por ejemplo, proteína sérica de unión a un ácido graso intestinal (un marcador para el daño de células epiteliales intestinales), así como alquilresorcinoles y péptidos del gluten en orina (ambos marcadores de la exposición al gluten); estos biomarcadores se desarrollan en la actualidad y podrían ser útiles en el futuro. La comunidad académica, las organizaciones de pacientes y los grupos de apoyo y la industria alimentaria deben cooperar de manera innovadora para lograr una vida mejor para los pacientes con enfermedad celíaca.
Coeliac disease
Katri Lindfors, Carolina Ciacci, Kalle Kurppa, Knut E. A. Lundin, Govind K. Makharia, M. Luisa Mearin, Joseph A. Murray, Elena F. Verdu & Katri Kaukinen
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Bárbara Elizondo Villarreal Profesor
Dra. Ligia Libeth Carrasco Díaz Residente 1er Año
Dra. Alejandra Macías Weinmann Profesor




No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.