Mecanismos moleculares que regulan el oxígeno
Investigación sobre los mecanismos moleculares que subyacen en la forma en que las células se adaptan a las variaciones en el suministro de oxígeno.

- William G. Kaelin, Jr. nació en 1957 en Nueva York. Obtuvo un M.D. de la Universidad de Duke, Durham. Realizó su formación especializada en medicina interna y oncología en la Universidad Johns Hopkins, Baltimore, y en el Instituto del Cáncer Dana-Farber, Boston. Estableció su propio laboratorio de investigación en el Instituto del Cáncer Dana-Farber y se convirtió en profesor titular en la Escuela de Medicina de Harvard en 2002. Es investigador del Instituto Médico Howard Hughes desde 1998.
- Sir Peter J. Ratcliffe nació en 1954 en Lancashire, Reino Unido. Estudió medicina en Gonville y Caius College en la Universidad de Cambridge e hizo su formación especializada en nefrología en Oxford. Estableció un grupo de investigación independiente en la Universidad de Oxford y se convirtió en profesor titular en 1996. Es Director de Investigación Clínica en el Instituto Francis Crick, Londres, Director del Instituto Target Discovery en Oxford y Miembro del Instituto Ludwig para la Investigación del Cáncer.
- Gregg L. Semenza nació en 1956 en Nueva York. Obtuvo su B.A. en biología de la Universidad de Harvard, Boston. Recibió un doctorado / doctorado de la Universidad de Pennsilvania, Facultad de Medicina, Filadelfia en 1984 y se formó como especialista en pediatría en la Universidad de Duke, Durham. Realizó capacitación posdoctoral en la Universidad Johns Hopkins, Baltimore, donde también estableció un grupo de investigación independiente. Se convirtió en profesor titular en la Universidad Johns Hopkins en 1999 y desde 2003 es el Director del Programa de Investigación Vascular en el Instituto Johns Hopkins de Ingeniería Celular.
Las investigaciones
Los galardonados con medicina 2019 William G. Kaelin Jr, Sir Peter J. Ratcliffe y Gregg L. Semenza han identificado maquinaria molecular que regula la actividad de los genes en respuesta a los niveles variables de oxígeno.
La importancia fundamental del oxígeno se ha entendido durante siglos, pero se desconoce cómo las células se adaptan a los cambios en los niveles de oxígeno. El trabajo premiado con el Nobel de este año revela los mecanismos moleculares que subyacen en la forma en que las células se adaptan a las variaciones en el suministro de oxígeno.
Durante la evolución, se desarrollaron mecanismos para garantizar un suministro suficiente de oxígeno a los tejidos y las células. El cuerpo carotídeo, adyacente a los vasos sanguíneos grandes a ambos lados del cuello, contiene células especializadas que detectan los niveles de oxígeno en la sangre.
El Premio Nobel de Fisiología o Medicina de 1938 a Corneille Heymans otorgó descubrimientos que muestran cómo la detección de oxígeno en la sangre a través del cuerpo carotídeo controla nuestra frecuencia respiratoria al comunicarse directamente con el cerebro.

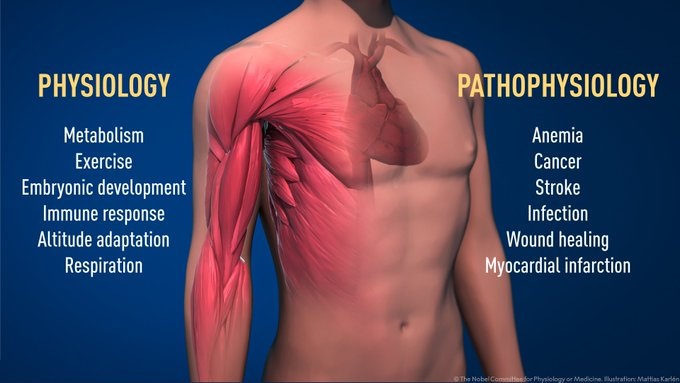
La detección de oxígeno es fundamental para una gran cantidad de enfermedades. Los descubrimientos realizados por los galardonados con el premioNobel de este año tienen una importancia fundamental para la fisiología y han allanado el camino para nuevas estrategias prometedoras para combatir la anemia, el cáncer y muchas otras enfermedades.
HIF entra en escena
Además de la adaptación rápida controlada por el cuerpo carotídeo a niveles bajos de oxígeno (hipoxia), existen otras adaptaciones fisiológicas fundamentales. Una respuesta fisiológica clave a la hipoxia es el aumento de los niveles de la hormona eritropoyetina (EPO), que conduce a una mayor producción de glóbulos rojos (eritropoyesis). La importancia del control hormonal de la eritropoyesis ya se conocía a principios del siglo XX, pero la forma en que este proceso fue controlado por el O2 siguió siendo un misterio.
Gregg Semenza estudió el gen EPO y cómo está regulado por niveles variables de oxígeno. Al usar ratones modificados con genes, se demostró que segmentos específicos de ADN ubicados al lado del gen EPO median la respuesta a la hipoxia. Sir Peter Ratcliffe también estudió la regulación dependiente de O2 del gen EPO, y ambos grupos de investigación encontraron que el mecanismo de detección de oxígeno estaba presente en prácticamente todos los tejidos, no solo en las células renales donde normalmente se produce EPO. Estos fueron hallazgos importantes que muestran que el mecanismo era general y funcional en muchos tipos de células diferentes.
Semenza deseaba identificar los componentes celulares que median esta respuesta. En las células hepáticas cultivadas descubrió un complejo proteico que se une al segmento de ADN identificado de una manera dependiente del oxígeno. Llamó a este complejo el factor inducible por hipoxia (HIF).
Se iniciaron grandes esfuerzos para purificar el complejo HIF, y en 1995, Semenza pudo publicar algunos de sus hallazgos clave, incluida la identificación de los genes que codifican HIF. Se descubrió que HIF consistía en dos proteínas de unión a ADN diferentes, llamadas factores de transcripción, ahora llamados HIF-1α y ARNT. Ahora los investigadores podrían comenzar a resolver el rompecabezas, permitiéndoles comprender qué componentes adicionales estaban involucrados y cómo funciona la maquinaria.
Cuando los niveles de oxígeno son bajos (hipoxia), HIF-1α está protegido de la degradación y se acumula en el núcleo, donde se asocia con ARNT y se une a secuencias de ADN específicas (HRE) en genes regulados por hipoxia.
A niveles normales de oxígeno, el proteasoma degrada rápidamente HIF-1α. El oxígeno regula el proceso de degradación mediante la adición de grupos hidroxilo (OH) a HIF-1α.
La proteína VHL puede reconocer y formar un complejo con HIF-1α que conduce a su degradación de una manera dependiente del oxígeno.
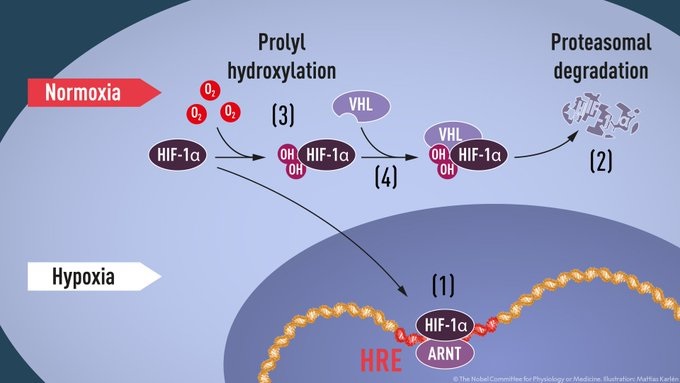
Cuando los niveles de oxígeno son altos, las células contienen muy poco HIF-1α. Sin embargo, cuando los niveles de oxígeno son bajos, la cantidad de HIF-1α aumenta para que pueda unirse y así regular el gen EPO y otros genes con segmentos de ADN que se unen a HIF (Figura 1). Varios grupos de investigación mostraron que HIF-1α, que normalmente se degrada rápidamente, está protegido de la degradación en la hipoxia.
A niveles normales de oxígeno, una máquina celular llamada proteasoma, reconocida por el Premio Nobel de Química 2004 a Aaron Ciechanover, Avram Hershko e Irwin Rose, degrada el HIF-1α. En tales condiciones, se agrega un péptido pequeño, ubiquitina, a la proteína HIF-1α. La ubiquitina funciona como una etiqueta para proteínas destinadas a la degradación en el proteasoma. Cómo la ubiquitina se une al HIF-1α de manera dependiente del oxígeno siguió siendo una cuestión central.
La respuesta vino de una dirección inesperada. Casi al mismo tiempo que Semenza y Ratcliffe estaban explorando la regulación del gen EPO, el investigador del cáncer William Kaelin, Jr. estaba investigando un síndrome hereditario, la enfermedad de von Hippel-Lindau (enfermedad de VHL). Esta enfermedad genética conduce a un riesgo dramáticamente mayor de ciertos tipos de cáncer en familias con mutaciones de VHL heredadas. Kaelin demostró que el gen VHL codifica una proteína que previene la aparición de cáncer.
Kaelin también mostró que las células cancerosas que carecen de un gen VHL funcional expresan niveles anormalmente altos de genes regulados por hipoxia; pero que cuando el gen VHL se reintrodujo en las células cancerosas, se restablecieron los niveles normales.
Esta fue una pista importante que muestra que la BVS estuvo de alguna manera involucrada en el control de las respuestas a la hipoxia. Se obtuvieron pistas adicionales de varios grupos de investigación que muestran que VHL es parte de un complejo que etiqueta las proteínas con ubiquitina, marcándolas para la degradación en el proteasoma.
Ratcliffe y su grupo de investigación hicieron un descubrimiento clave: demostrar que VHL puede interactuar físicamente con HIF-1α y es necesario para su degradación a niveles normales de oxígeno. Esto vincula de modo concluyente VHL a HIF-1α.
El oxígeno da forma a la fisiología y la patología
Gracias al trabajo innovador de estos premios Nobel, sabemos mucho más sobre cómo los diferentes niveles de oxígeno regulan los procesos fisiológicos fundamentales. La detección de oxígeno permite a las células adaptar su metabolismo a niveles bajos de oxígeno: por ejemplo, en nuestros músculos durante el ejercicio intenso.
Otros ejemplos de procesos adaptativos controlados por la detección de oxígeno incluyen la generación de nuevos vasos sanguíneos y la producción de glóbulos rojos. Nuestro sistema inmunológico y muchas otras funciones fisiológicas también están afinadas por la maquinaria de detección de O2. Incluso se ha demostrado que la detección de oxígeno es esencial durante el desarrollo fetal para controlar la formación normal de vasos sanguíneos y el desarrollo de placenta.
La detección de oxígeno es fundamental para una gran cantidad de enfermedades.Por ejemplo, los pacientes con insuficiencia renal crónica a menudo sufren anemia severa debido a la disminución de la expresión de EPO. La EPO es producida por células en el riñón y es esencial para controlar la formación de glóbulos rojos. Además, la maquinaria regulada por el oxígeno tiene un papel importante en el cáncer. En los tumores, la maquinaria regulada por oxígeno se utiliza para estimular la formación de vasos sanguíneos y remodelar el metabolismo para la proliferación efectiva de células cancerosas.
Intensos esfuerzos continuos en laboratorios académicos y compañías farmacéuticas ahora se centran en el desarrollo de medicamentos que pueden interferir con diferentes estados de enfermedad al activar o bloquear la maquinaria de detección de oxígeno.
Fuente:



No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.