Antes de la primera descripción de la fiebre del heno (rinitis alérgica) en 1819 por John Bostock y la primera serie de casos publicada en 1873 por Charles Blackley, había poca conciencia de las enfermedades alérgicas. En ese momento, se reconoció un aumento en la alergia al polen de gramíneas, que conducía a la fiebre del heno, y luego se atribuyó a una dosis alta de exposición a alérgenos debido a la introducción de pastos muy polinizadores para producir heno para los rebaños lecheros en Europa y debido al aumento del crecimiento de ambrosía en y alrededor de los campos arados en los EE. UU. Al representar la primera ola de epidemias de alergias, la rinitis alérgica ya era común a fines del siglo XIX y su prevalencia continuó en aumento a lo largo del siglo XX. La incidencia de asma alérgica y dermatitis atópica comenzó a crecer hasta alcanzar proporciones epidémicas después de la década de 1960 (Cuadro 1). Desde el año 2000, la prevalencia de alergia alimentaria, esofagitis eosinofílica y anafilaxia inducida por fármacos aumentó hasta alcanzar proporciones epidémicas. Además, desde la década de 1960 se registró en los países industrializados un aumento sustancial de las enfermedades autoinmunes y metabólicas, como la diabetes, la obesidad, la artritis reumatoide, la esclerosis múltiple y la enfermedad celíaca, y esta tendencia continúa en la actualidad. Durante el mismo período, se observó un aumento significativo en la prevalencia de IgG e IgE específicas contra alérgenos. Los anticuerpos IgG específicos a alérgenos rara vez se detectaron en las décadas de 1970 y 1980, mientras que, en 2018, se detectaron anticuerpos IgG específicos a la leche y específicos al huevo en casi todos los bebés evaluados a la edad de 1 año. En la actualidad, la prevalencia de IgE específica a alérgenos (a cualquier alérgeno) supera 50% de la población en Europa, América del Norte y Australia (Cuadro 1).
El inicio reciente de las epidemias de enfermedades alérgicas, autoinmunes y metabólicas lleva a la pregunta de qué podría estar detrás de su desarrollo. La predisposición genética, los cambios en el estilo de vida debido a la urbanización y la modernización, el aumento de las tasas de nacimiento por cesárea, el aumento del uso temprano de antibióticos, una dieta occidentalizada y la obesidad desempeñan un papel importante. Una hipótesis destacada es la hipótesis de la higiene, que propone que determinados microorganismos protegen frente a enfermedades inflamatorias y que su pérdida, por medidas de higiene, se traduce en un aumento de la alergia, el asma y la autoinmunidad. Se propusieron varias extensiones a la hipótesis de la higiene. Una es la hipótesis de los “viejos amigos”, que sugiere que algunas especies microbianas evolucionaron en conjunto con los seres humanos y los animales que las rodean y tienen funciones protectoras (Cuadro 2). Otra es la hipótesis de la biodiversidad, que propone que un microbioma humano enriquecido promueve el equilibrio inmunológico y protege de las alergias y otros trastornos inflamatorios (Cuadro 3). Estas tres hipótesis se centran en el papel de la microbiota en condiciones que involucran respuestas inmunes inapropiadas y postulan que los cambios en la composición de los microbios que encontramos son la principal razón para el desarrollo de enfermedades y patologías.
Las primeras conexiones entre la microbiota, la alteración epitelial y la enfermedad inflamatoria se establecieron a finales de la década de 1980 y principios de la de 1990 con el descubrimiento del vínculo entre una barrera intestinal desregulada y la enfermedad inflamatoria intestinal y la enfermedad celíaca. De forma posterior, se demostraron barreras epiteliales defectuosas en órganos afectados en asma, dermatitis atópica, rinitis alérgica, rinosinusitis crónica (RSC) y esofagitis eosinofílica.
Se desarrollaron varias estrategias terapéuticas que tienen como objetivo prevenir la pérdida de la integridad de la barrera epitelial o restaurar la disfunción de la barrera. Estos incluyen la selección de moléculas que alteran la barrera, agentes que funcionan mediante la regulación epigenética de la integridad de la barrera, varios tipos de modalidades de curación para las barreras defectuosas y esfuerzos en la prevención del eccema y la sensibilización a los alimentos en las cohortes de nacimiento, como el uso de emolientes y medidas de control de la exposición ambiental para proteger la barrera cutánea. Además, se desarrollaron métodos eficaces para la detección de fugas de barrera. En 2017, Pothoven y Schleimer propusieron la “hipótesis de la barrera” para las enfermedades inflamatorias tipo 2, que postula que la disfunción de la barrera epitelial puede provocar el desarrollo de alergia.
Aquí, se extienden las hipótesis postuladas con anterioridad para el aumento de la prevalencia de enfermedades alérgicas y autoinmunes al argumentar que los cambios ambientales causados por la industrialización, la urbanización y un estilo de vida occidentalizado afectan la barrera epitelial de la piel, las vías respiratorias superiores e inferiores y la mucosa intestinal. El desarrollo de barreras epiteliales con fugas conduce a disbiosis microbiana y la translocación de bacterias a áreas interepiteliales y subepiteliales y el desarrollo de microinflamación tisular. Como una extensión de la hipótesis de la barrera propuesta por Pothoven y Schleimer, se propone que estos procesos subyacen no sólo al desarrollo de alergias y afecciones autoinmunes en los tejidos dañados por la barrera, sino también a una gama amplia de enfermedades en las que las respuestas inmunes a las bacterias translocadas tienen efectos sistémicos.
En general, las afecciones que son causadas o exacerbadas por epitelios dañados se dividen en tres categorías: (1) afecciones crónicas en las que los defectos de la barrera local causan patología en la piel y los tejidos mucosos afectados, como en las enfermedades alérgicas, la enfermedad inflamatoria intestinal y la enfermedad celíaca; (2) condiciones autoinmunes y metabólicas crónicas en las que las barreras con fugas y la disbiosis microbiana en el intestino contribuyen al inicio de la enfermedad y a exacerbaciones como en la diabetes tipo 1 y tipo 2, obesidad, artritis reumatoide, esclerosis múltiple, espondilitis anquilosante, hepatitis y lupus eritematoso sistémico; o (3) afecciones crónicas en las que los defectos de la barrera intestinal y la translocación microbiana se asocian con afecciones neurodegenerativas o psiquiátricas como el trastorno del espectro autista, la depresión crónica, los trastornos psiquiátricos relacionados con el estrés, la enfermedad de Parkinson y la enfermedad de Alzheimer, aunque aún no se demostraron relaciones causales (Tabla 1).
Esta revisión analiza en primer lugar los cambios ambientales durante las últimas décadas que llevaron a un aumento de las agresiones de la barrera epitelial. Luego examina la participación de las células epiteliales en las respuestas inflamatorias y la regulación de las barreras epiteliales por las respuestas inmunes, así como la participación de la microbiota en este proceso. Por último, se revisan las enfermedades crónicas y su conexión con el daño de la barrera epitelial.
Agentes que causan daño a la barrera epitelial.
Varios alérgenos, patógenos y toxinas ambientales pueden dañar la barrera epitelial. Estos incluyen alérgenos derivados de los ácaros del polvo, ciertas bacterias, hongos, virus y toxinas que se encuentran en los agentes de lavandería, lavavajillas y limpieza del hogar. Además, se demostró que los tensioactivos, las enzimas y los emulsionantes en los alimentos procesados, el humo de los cigarrillos, el material particulado, los gases de escape de diésel, el ozono, las nanopartículas y los microplásticos dañan la barrera epitelial (Tabla 2). Los seres humanos encuentran un gran número de estas sustancias como consecuencia de la industrialización, la urbanización y la modernización. En particular, se demostró que los detergentes utilizados en la ropa, el lavavajillas y los agentes de limpieza domésticos son tóxicos de forma directa para las células epiteliales. Un mayor uso de detergentes en general y la adición de tensioactivos y enzimas proteolíticas a los detergentes comerciales aumentó de forma significativa la exposición diaria del público a agentes que dañan la barrera epitelial. Numerosos estudios demuestran evidencia epidemiológica de una conexión entre la exposición a detergentes y el desarrollo de asma y enfermedad atópica.
El daño de la barrera epitelial causado por los detergentes para ropa en la piel humana y las células epiteliales bronquiales se investigó de forma reciente en dos estudios. Incluso a diluciones altas, la exposición a detergentes para ropa interrumpió la función de barrera epitelial de la piel humana y las células epiteliales bronquiales. Un análisis del transcriptoma de las células epiteliales bronquiales expuestas a detergente para ropa diluido 50,000 veces demostró un aumento de la expresión de los genes implicados en el metabolismo de los lípidos, el estrés oxidativo y la supervivencia celular, una disminución de la expresión de los genes implicados en la adhesión celular, la organización de la matriz extracelular y la cicatrización de heridas, y aumento de la expresión de la IL-33. Los dos tensioactivos más utilizados en detergentes, jabones, champús y muchos otros productos de limpieza, es decir, el dodecilsulfato de sodio y el dodecilbencenosulfonato de sodio, dañan la barrera de unión estrecha (UE) del pulmón y el epitelio de la piel incluso en diluciones de hasta 100,000 veces en cultivos de interfase aire-líquido de células primarias humanas. Se demostró que el líquido posterior al enjuague recogido de las toallas y la ropa lavadas todavía contiene detergentes activos y tensioactivos que pueden dañar la barrera epitelial.
También existe una evidencia acumulada de un efecto perjudicial de los emulsionantes en los alimentos procesados, que se demostró que aumentan la permeabilidad intestinal incluso en concentraciones bajas. Algunos de los emulsionantes alimentarios aprobados son tensioactivos que se comportan como detergentes, e incluso trazas de estos agentes aumentan de forma notable la translocación bacteriana en modelos múridos. Todas estas sustancias mencionadas con anterioridad pueden mostrar efectos sinérgicos incluso a concentraciones bajas y la inflamación epitelial crónica puede aumentar aún más sus efectos.
Regulación de las barreras epiteliales
La barrera epitelial en las vías respiratorias, el intestino y el esófago se conforma por moco, microbiota, líquidos superficiales y complejos de unión entre células epiteliales adyacentes que comprenden la UE y uniones adherentes. Las moléculas de unión interepitelial se unen por medio de interacciones homotípicas y heterotípicas, establecen contacto célula-célula y regulan el paso de moléculas y partículas pequeñas entre las células. En la piel, el estrato córneo forma una barrera física más fuerte que las membranas mucosas debido a la expresión de proteínas como la filagrina formadora de filamentos y la proteína estructural loricrina, su compañera de interacción involucrina y la proteína similar a la profilagrina hornerina. Las células epiteliales también desempeñan un papel en las respuestas inmunitarias innatas al facilitar el aclaramiento mucociliar, producir péptidos antimicrobianos, citocinas y quimiocinas, activar células intraepiteliales y subepiteliales y reclutarlas en los tejidos, lo que respalda una barrera física, química e inmunológica.
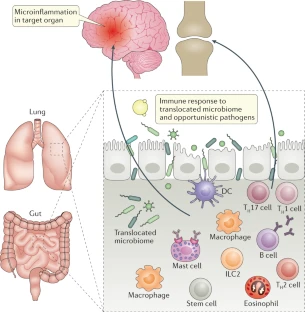
La capacidad del epitelio para controlar el equilibrio del daño tisular y reparar las señales es esencial para limitar la lesión tisular y controlar la resolución de la inflamación durante la reparación tisular. Los estudios realizados en el intestino, la piel, el esófago, los bronquios y los senos nasales demostraron que se pueden inducir respuestas inflamatorias como consecuencia de una apertura de la barrera epitelial, lo que da lugar a un círculo vicioso en el que la propia inflamación subepitelial mantiene las barreras dañadas y abiertas (Figura 1). Las UE epiteliales cerradas en el epitelio de la mucosa protegen contra el exposoma, incluidos alérgenos, contaminantes, microbios y sus enzimas y toxinas. Las UE epiteliales abiertas en la mucosa ayudan a drenar las células inmunes y las moléculas proinflamatorias de la inflamación subepitelial, pero de manera simultánea permiten la entrada de sustancias extrañas a los tejidos más profundos. En general, se producen una serie de eventos patológicos en la disrupción crónica de la barrera, que incluyen disbiosis y translocación microbiana, colonización y una respuesta inmune a patógenos oportunistas, así como el desarrollo de respuestas crónicas de células T, de manera particular respuestas tipo 2 en las enfermedades alérgicas (Fig. 1).
Disbiosis microbiana y translocación. Cuando la microbiota que por lo general se encuentra en la superficie del epitelio se traslada a las capas más profundas debajo de las células epiteliales, estimula el sistema inmunológico y contribuye a los procesos inflamatorios. La disbiosis microbiana y la translocación transepitelial de microbios comensales, así como una mayor colonización por patógenos oportunistas, es un sello distintivo de los tejidos dañados por la barrera. La translocación microbiana a través de la mucosa intestinal dañada se reportó en muchas enfermedades (Tabla 1).
Como se mencionó con anterioridad, esto puede conducir a un círculo vicioso que promueve tanto la inflamación como el daño de la barrera. El desarrollo de un escenario de herida crónica es una consecuencia importante de la translocación microbiana caracterizada por inflamación local crónica. Las células epiteliales primarias se originan a partir de células epiteliales basales, que se dividen, diferencian y sintetizan moléculas de barrera. Las células inmunes, como las células dendríticas, los macrófagos, las células linfoides innatas (CLI) y las células T, y sus citocinas en el entorno inflamatorio crónico son fundamentales en la regeneración de las células madre y la barrera epitelial. En este escenario, la reconstitución de un epitelio sano se obstaculiza porque las células madre epiteliales no pueden construir una barrera fuerte en un microambiente inflamatorio como se demostró para las células madre del epitelio bronquial, de los senos nasales y de la piel.
Los experimentos ex vivo demostraron que las células epiteliales primarias recolectadas de los tejidos con fugas de la barrera no pueden restaurar la integridad de la barrera, sino que contribuyen al mantenimiento de la barrera con fugas. En la enfermedad de Crohn, de forma reciente se identificó un mecanismo protector antes desconocido que previene la diseminación sistémica de bacterias translocadas. El fenómeno se llama “grasa deslizante”, donde el tejido adiposo mesentérico con una rica capacidad profibrótica y proadipogénica migra a sitios de disfunción de la barrera intestinal, lo que lleva al desarrollo de una barrera de tejido adiposo que intenta compensar la deficiencia de la barrera epitelial. La filtración de la barrera epitelial parece codificarse de forma epigenética en los tejidos defectuosos de la barrera. En un modelo múrido de inflamación respiratoria y en cultivos de interfaz aire-líquido de células epiteliales bronquiales humanas primarias, se demostró que la inhibición de la histona desacetilasa puede restaurar la integridad de la barrera.
Regulación de las barreras epiteliales por respuestas inmunes locales. Una respuesta inmune tipo 2 es el mecanismo predeterminado esencial para la defensa contra parásitos y venenos. Abre la barrera epitelial y representa una respuesta inmune muy específica para matar o expulsar helmintos, al mismo tiempo que limita la lesión tisular, mantiene la homeostasis tisular y contribuye a la regeneración y fibrosis tisular. En 1932, Willem Löffler describió la neumonía eosinofílica dirigida contra los helmintos. Durante su ciclo de vida, los huevos fertilizados de helmintos se ingieren y eclosionan en el intestino y las larvas, que miden ~0.5 mm de tamaño, migran a los pulmones. Sin embargo, los helmintos, como el ascaris, crecen hasta alcanzar un tamaño adulto de 15 a 20 cm. En el pulmón, una fuerte respuesta de expulsión tipo 2 con neumonía eosinofílica, junto con la apertura de las barreras epiteliales, asegura que las larvas se expulsen por completo antes de que crezcan demasiado. Llegan al tracto gastrointestinal donde los parásitos pueden seguir creciendo. De manera similar, también ocurre una fisiopatología similar a la expulsión en la respuesta inmune a parásitos de la piel como la escabiasis. Como respuesta inmune predeterminada contra los parásitos de la piel, es probable que una de las funciones principales de una respuesta tipo 2 en la piel sea expulsar el “peligro” de los tejidos profundos. Esto puede resultar en prurito grave, rascado y drenaje transepidérmico a través y fuera de la piel inflamada, como se observa en la dermatitis atópica.
Condiciones como el asma, la RSC y la dermatitis atópica se caracterizan por respuestas inmunes sistémicas tipo 2 con células T cooperadoras 2 (TH2) en proliferación activadas y CLI tipo 2 activadas, y la focalización de citocinas tipo 2, como IL-4, IL- 5 e IL-13, se utilizaron con éxito para el tratamiento de estas enfermedades. Se encontraron células inmunes circulantes activadas que pueden migrar a varios tejidos en la sangre periférica de pacientes con diversas enfermedades inflamatorias crónicas. Se reportó que las células T de memoria específicas a alérgenos circulantes en enfermedades alérgicas tienen una frecuencia de 1 en 104 a 105 células T. Sin embargo, una respuesta inmune tipo 2 en personas con alergias o asma no se limita sólo a las células T específicas a alérgenos, sino que también incluye un sesgo general de la respuesta inmune hacia el desarrollo células T tipo 2 que se dirigen a la piel y expresan el antígeno asociado a linfocitos cutáneo (CLA+), células T que expresan receptor de quimiocinas TH2 (CRTH2+), CLI tipo 2, células B y eosinófilos CRTH2+. La migración de las células T activadas a otros órganos, donde luego causan inflamación, se demostró para las células T específicas a alérgenos alimentarios y que se dirigen a la piel que se sensibilizan en el intestino y migran a la piel, donde causan dermatitis atópica. La activación extensa de las células T debido a las barreras epiteliales permeables podría ser un mecanismo responsable de la marcha atópica de enfermedades alérgicas en el orden secuencial de dermatitis atópica, alergia alimentaria, asma y rinitis alérgica durante la infancia.
Además de las respuestas tipo 2, las respuestas tipo 1 por debajo de la superficie de la mucosa se caracterizan por una apertura de la barrera epitelial seguida de la inducción de apoptosis en las células epiteliales, lo que provoca una lesión tisular. Se reportó que el interferón γ (IFNγ), el FAS, el ligando FAS, el factor de necrosis tumoral (TNF) y el inductor débil de apoptosis similar al TNF (TWEAK) son moléculas responsables de la muerte de los queratinocitos de la piel en el eccema, la muerte de las células epiteliales de la mucosa y la diseminación en el asma, la RSC y la colitis. Hasta ahora no se demostraron los posibles efectos directos de apertura de la barrera de la IL-17 y la IL-22. Por el contrario, estudios recientes sugieren un papel protector de barrera para las respuestas tipo TH17 y tipo TH22. De forma interesante, se sugirió que las células inmunitarias innatas que expresan CD161 de tipo TH17 protegen la barrera intestinal en un modelo de inflamación y envejecimiento en monos rhesus. Aquí, la producción de IL-17 e IL-22 por los subconjuntos de células T CD161+ y las células asesinas naturales se vio afectada, mientras que la producción de IFN γ y la permeabilidad intestinal aumentaron. Como mecanismos adicionales en la alteración de la barrera, la activación del inflamosoma y la respuesta al estrés celular grave, como las quemaduras, provocan fugas en la barrera, disbiosis microbiana y traslocación bacteriana.
Respuesta inmune al microbioma disbiótico y patógenos oportunistas. Una característica importante de la inflamación crónica de la mucosa es el desarrollo de una respuesta inmune hacia patógenos facultativos recién colonizados. Ésta es una respuesta de expulsión de forma típica mediada por una respuesta inflamatoria tipo 2, como se discutió con anterioridad, pero también puede ser una respuesta mixta que incluye los componentes inflamatorios de las respuestas tipo 1 y tipo 17, de acuerdo con los factores locales y sistémicos. Se demostró que tanto los procesos inflamatorios tipo 1 como los tipo 2 pueden ocurrir debajo del epitelio y dar lugar a una apertura de la barrera de uniones estrechas. Es importante enfatizar que la mayoría de los modelos múridos de inflamación de la mucosa, como el asma, la rinitis y la colitis, se crean mediante el uso de un agente que daña la barrera como la papaína, la toxina del cólera, lipopolisacárido, dextrano sulfato sódico u oxazolona.
Un ejemplo típico de un patógeno oportunista que induce una respuesta tipo 2 en tejidos inflamatorios alérgicos es el Staphylococcus aureus, que es la bacteria más abundante que coloniza los tejidos dañados por la barrera en la piel y la mucosa respiratoria superior. Una ruptura de la barrera epitelial por S. aureus se asocia con asma, RSC y dermatitis atópica, y una alta prevalencia de anticuerpos IgE específicos para antígenos de S. aureus se correlaciona con la gravedad y la exacerbación de la enfermedad en los mismos pacientes (Cuadro 1). La colonización por S. aureus compromete aún más la barrera mucosa si el epitelio ya se alteró. Como se discutió con anterioridad, y similar a la respuesta de expulsión de larvas de parásitos por defecto, las respuestas tipo 2 también pueden resultar en la expulsión de microbios que se trasladan a los tejidos subepiteliales. Sin embargo, las bacterias translocadas no se pueden expulsar de forma fácil y la barrera no se puede cerrar en este tipo de inflamación crónica de la mucosa, quizá porque las señales de los microbios comensales y los patógenos facultativos recién colonizados son demasiado débiles para estimular una respuesta antibacteriana adecuada seguida de una cicatrización total del tejido. Además, una respuesta tipo 2 por lo general no implica una respuesta inmunitaria neutralizante contra los microbios y, por lo tanto, es más probable que conduzca a la cronicidad en lugar de a la eliminación del microbio.
Además del S. aureus, ciertos patógenos facultativos, como Streptococcus pneumoniae, Haemophilus influenzae y Moraxella catarrhalis, también se asocian con el desarrollo de asma. Un crecimiento excesivo de tales patógenos facultativos también conduce a una disminución de la biodiversidad local del microbioma, lo que puede contribuir al desarrollo de enfermedades alérgicas como postula la hipótesis de la higiene. De forma interesante, se demostró que los niños con asma exhiben una respuesta inmune aberrante a los patógenos oportunistas antes de desarrollar asma. En este punto, las células T pueden detectarse en sangre y se demostró que producen IL-5, IL-17 e IL-10 en respuesta a la incubación experimental con H. influenzae, M. catarrhalis y S. pneumonia, así como con bacterias comensales. Las bacterias filamentosas segmentarias pueden inducir respuestas de células TH17, que desempeñan un papel en el control de la invasión bacteriana en tejidos más profundos; por otro lado, estas respuestas inmunes pueden conducir al desarrollo de enfermedades autoinmunes como la enfermedad inflamatoria intestinal, la esclerosis múltiple y la artritis reumatoide.
Enfermedades crónicas vinculadas al daño de la barrera
Los mecanismos de daño y regulación de la barrera epitelial y su vínculo con las enfermedades crónicas fueron un foco interesante de investigación durante varias décadas. Se reportó que un número significativo de enfermedades crónicas no transmisibles incluyen defectos de la barrera epitelial y disbiosis microbiana en su patogenia. Estos pueden clasificarse como afecciones debidas a inflamación directa en los tejidos afectados, enfermedades autoinmunes y metabólicas asociadas con defectos de las vías respiratorias o de la barrera intestinal, o enfermedades neuropsiquiátricas relacionadas con la disbiosis microbiana y la filtración de la barrera intestinal (Tabla 1).
Enfermedades crónicas con defectos de la barrera local. El daño de la barrera epitelial en los tejidos afectados es un sello distintivo de una gama amplia de enfermedades inflamatorias alérgicas. Estos incluyen asma, dermatitis atópica (eccema), RSC, esofagitis eosinofílica, alergia alimentaria y rinitis alérgica.
Las filagrinas, que forman un componente clave del estrato córneo, y las UE en el estrato granuloso, proporcionan dos capas de barrera cutánea, y los defectos genéticos en ambas capas se asociaron con la dermatitis atópica. La filtración de la barrera cutánea debido a mutaciones de la filagrina también se asoció con una gama amplia de enfermedades alérgicas y sensibilización IgE, lo que sugiere que las barreras epiteliales comprometidas conducen a muchas enfermedades inflamatorias crónicas. En particular, el vínculo entre el deterioro de la barrera cutánea y muchas enfermedades alérgicas sugiere que un diagnóstico temprano de los defectos de la barrera y la protección de la barrera cutánea tendrían efectos beneficiosos en la prevención de enfermedades. La exposición a muchos de los agentes enumerados en la Tabla 2 y la Tabla 3, como detergentes, emulsionantes alimentarios, material particulado, ozono y alérgenos, en la primera infancia bien podría ser relevante para el desarrollo de sensibilización a alérgenos en los primeros años de vida, además de mutaciones ya existentes en moléculas de la barrera y disbiosis bacteriana. Los defectos de la barrera intestinal, que representan otro grupo de enfermedades con inflamación local en los tejidos afectados, se relacionan con la enfermedad inflamatoria intestinal y la enfermedad celíaca.
Defectos de la barrera epitelial en enfermedades sistémicas autoinmunes y metabólicas. El segundo grupo de afecciones en las que la patología se asocia con la filtración de la barrera y la disbiosis microbiana incluye enfermedades autoinmunes y metabólicas que afectan a órganos distantes del sitio de la filtración de la barrera. Estos incluyen artritis reumatoide, esclerosis múltiple, espondilitis anquilosante, varios tipos de hepatitis, lupus eritematoso sistémico, diabetes tipo 1 y tipo 2 y obesidad.
Uno de los eventos patogénicos característicos en este grupo de condiciones parece ser la activación de células inmunes patogénicas en los tejidos de la mucosa con barreras rotas, que luego migran a los órganos afectados (Fig. 2). Por ejemplo, la contaminación del aire y la exposición a partículas en suspensión se asocian con un aumento de la actividad de la enfermedad en la esclerosis múltiple junto con un aumento de las células T CCR6+ CD4+ con propiedades migratorias que pueden permitirles atravesar la barrera hematoencefálica. Además, aumenta el número de células dendríticas mieloides que expresan citocinas como IL-1β, IL-6 e IL-23, que estimulan el desarrollo de células TH17 (Fig. 2). En un modelo de rata de encefalomielitis autoinmune, se demostró que las células T específicas a mielina no entran de forma directa en el sistema nervioso central. En cambio, primero se “autorizan” en los pulmones, lo que luego les permite ingresar al sistema nervioso central, donde inducen el desarrollo de una inflamación similar a la de la esclerosis múltiple. Aunque este estudio no especificó la alteración de la barrera, la enfermedad en este modelo se indujo mediante la administración de autoantígeno junto con lipopolisacáridos y el adyuvante completo de Freund, los cuales pueden alterar las barreras tisulares.
También se reportó un vínculo entre la inflamación distante en el área de la enfermedad y la filtración de la barrera intestinal en un modelo múrido de artritis. Aquí, se encontró que las células T efectoras migraban desde la lámina propia del intestino permeable hacia la membrana sinovial, donde causaron patología. Este estudio demostró los aspectos clave de la hipótesis de la barrera extendida, en el sentido de que el defecto de la barrera intestinal provocó disbiosis microbiana que, a su vez, provocó inflamación en un sitio distante (Fig. 2). Para apoyar aún más esta hipótesis, se demostró que la restauración de la barrera intestinal al usar butirato, un agonista del receptor de cannabinoides tipo 1, o el tratamiento con el antagonista de zonulina acetato de larazotida, inhibió el desarrollo de artritis en este modelo múrido. Aunque se demostró que las barreras defectuosas en los pulmones y la mucosa gastrointestinal son sitios para la activación celular, incluida la activación de las células presentadoras de antígenos, se necesita más investigación para estudiar cómo se activan en estos tejidos las células inmunes con función patógena potencial.
Cuando se rompen las barreras epiteliales en el tracto intestinal o respiratorio, puede producirse la ruptura de otras barreras, como la barrera hematoencefálica u otras barreras endoteliales vasculares, como en el ojo, y los defectos de permeabilidad en estas barreras pueden conducir a la formación de células inmunes. reclutamiento y activación. Este proceso puede ser la base del desarrollo de diversos trastornos metabólicos y autoinmunitarios.
Varios estudios investigaron si un intestino permeable o una barrera respiratoria interrumpida son los iniciadores o las consecuencias del desarrollo de la enfermedad. En la diabetes tipo 1, estudios recientes apuntan a un intestino permeable como iniciador, dado que la disfunción subclínica de la barrera intestinal puede detectarse en individuos antes del inicio clínico de la enfermedad. Además, en un modelo de rata de diabetes tipo 1 espontánea, se produjo un aumento de la permeabilidad gástrica y del intestino delgado antes de la insulitis y la diabetes clínica. En particular, las barreras epiteliales también se regulan por mecanismos metabólicos, por ejemplo, las concentraciones altas de glucosa en los tejidos debido a la resistencia a la insulina pueden afectar de forma negativa la impermeabilidad de las barreras epiteliales. En cultivos de células epiteliales de las vías respiratorias se demostró que los niveles altos de glucosa pueden conducir a la disminución de la expresión de las proteínas de la UE al disminuir la expresión de conexina 43, lo que sugiere un mecanismo de retroalimentación positiva para la continuación de la barrera intestinal desregulada en la diabetes. De forma paralela a los cambios metabólicos y los defectos de la barrera intestinal en la diabetes, también se observa en la obesidad una perturbación de la microbiota intestinal junto con una respuesta inflamatoria persistente de grado bajo en el intestino y el tejido graso.
Se demostró que varias toxinas bacterianas, como las enterotoxinas de S. aureus, la toxina zonula occludens de Vibrio cholera y las toxinas de Bacillus subtilis, dañan la barrera epitelial. La zonulina es un precursor de la proteína haptoglobina, un análogo humano de la toxina zonula occludens de V. cholera, que disminuye la función de las UE. Se propuso que esta proteína desempeña un papel en varias enfermedades autoinmunes. En un modelo de rata de diabetes tipo 1, se demostró que un inhibidor de zonulina puede revertir las manifestaciones de la enfermedad y la translocación microbiana en el intestino. En pacientes con artritis reumatoide, el aumento de los niveles séricos de zonulina se relaciona con una barrera intestinal con fugas y representa un objetivo para el tratamiento. De manera similar, en pacientes con esclerosis múltiple, el aumento de las concentraciones de zonulina se relacionó con la apertura de uniones estrechas y una ruptura tanto de la barrera intestinal como de la barrera hematoencefálica en respuesta a la disbiosis intestinal, lo que presenta un vínculo directo entre la patología de la enfermedad y la barrera intestinal.
Varios estudios también relacionan las barreras epiteliales alteradas con otras enfermedades autoinmunes. Por ejemplo, los pacientes con espondilitis anquilosante a menudo tienen daño en la barrera vascular y epitelial intestinal, disbiosis bacteriana y niveles elevados de zonulina sérica junto con ileítis bacteriana. Para el lupus eritematoso sistémico, se observaron defectos de barrera relacionados con la disbiosis microbiana en modelos humanos y múridos.
Diferentes tipos de enfermedades hepáticas, incluida la enfermedad del hígado graso (esteatohepatitis no alcohólica), la hepatitis autoinmune y la cirrosis hepática, se relacionan con defectos de la barrera intestinal. La incidencia de la enfermedad del hígado graso alcanza niveles epidémicos, con una prevalencia global de 25.4%, muestra una fuerte comorbilidad con la obesidad y la diabetes. Se descubrió que la alteración de las barreras vasculares y epiteliales intestinales y la disbiosis microbiana intestinal son eventos tempranos en la patogénesis de la enfermedad del hígado graso en modelos múridos y en pacientes.
La hepatitis autoinmune es un trastorno hepático inflamatorio, crónico y progresivo inmunomediado. En pacientes con hepatitis autoinmune se observó aumento de la permeabilidad intestinal, alteración del microbioma y translocación bacteriana, todos los cuales se correlacionaron con la gravedad de la enfermedad. La cirrosis hepática altera de forma profunda la barrera intestinal, lo que la hace más permeable y permite la translocación de bacterias, productos bacterianos y fragmentos hacia la circulación portal, y de esta manera perpetúa una respuesta inflamatoria local y sistémica anormal. Tanto el intestino permeable como la disbiosis bacteriana se involucran en el desarrollo de la cirrosis hepática en un círculo vicioso.
Defectos de la barrera epitelial en enfermedades neurodegenerativas y psiquiátricas. El vínculo entre la aparición y la progresión de las enfermedades neurodegenerativas y la inflamación crónica estéril es un tema activo de debate. Varios estudios recientes en animales y humanos sugieren una conexión entre el aumento de la filtración de la barrera intestinal y los trastornos neurodegenerativos y psiquiátricos como la enfermedad de Parkinson, la enfermedad de Alzheimer, los trastornos del espectro autista y la depresión crónica (Tabla 1). Estas condiciones aumentaron de forma sustancial en prevalencia durante el mismo período de tiempo que las enfermedades alérgicas y autoinmunes.
Los análisis de la función de la barrera de la pared intestinal en humanos se pueden realizar por medio de pruebas de permeabilidad in vivo, biopsias intestinales y tinción de inmunohistología in situ de proteínas de la UE, así como mediante pruebas de permeabilidad mucosa ex vivo. Además, se pueden analizar los biomarcadores séricos de la filtración de la barrera, como la zonulina y las proteínas detectables en muestras fecales. Dichos estudios apuntan a la filtración de la barrera intestinal y un estado microinflamatorio sistémico impulsado por disbiosis microbiana, células proinflamatorias que migran y defectos en la barrera hematoencefálica que conducen a la neuroinflamación como mecanismos patogénicos clave en este grupo de enfermedades.
Por ejemplo, un análisis posmortem de muestras intestinales demostró que 75% de las personas con trastorno del espectro autista tenían una expresión reducida de los componentes de las UE formadores de barrera (claudina 1, occludina y tricelulina), y 66% tenía una mayor expresión de claudinas formadoras de poros (claudinas 2, 10 y 15) en el epitelio intestinal, así como niveles leves de inflamación de la mucosa intestinal, así como niveles leves de inflamación de la mucosa intestinal. También hay evidencia de una asociación de la enfermedad de Alzheimer con barreras con fugas. En un modelo múrido de la enfermedad de Alzheimer, se mostró la disfunción de la barrera epitelial intestinal y el depósito de amiloide-β vascular en la mucosa intestinal antes de que fuera detectable la agregación cerebral de amiloide-β. Además, se identificó un aumento en las proteínas proinflamatorias en las células microgliales, las células endoteliales de la barrera hematoencefálica y las células inmunes circulantes en individuos con enfermedad de Alzheimer. Sin embargo, la mayoría de los estudios sobre las relaciones entre una barrera epitelial intestinal con fugas, disbiosis microbiana y neuroinflamación y neurodegeneración son de naturaleza correlativa, y queda por demostrar una relación causal completa.
Conclusión
Varias deficiencias de las hipótesis de higiene, viejos amigos y biodiversidad se discutieron durante las últimas décadas y sugieren que estas hipótesis no explican del todo el aumento en la prevalencia de enfermedades alérgicas y autoinmunes. Estas deficiencias incluyen el hecho de que el saneamiento del agua se estableció en muchas ciudades occidentales en la década de 1920, pero las epidemias de alergia y asma sólo comenzaron en la década de 1960. El papel protector de las infecciones parasitarias que aumentan la biodiversidad se cuestionó por la misma razón. Además, el asma alérgica aumenta en algunas ciudades de Asia y África que tienen niveles bajos de higiene. Otra limitación de las hipótesis de la higiene y la biodiversidad es que los probióticos no son alternativas viables para la prevención o el tratamiento de las alergias. Además, los estudios de migrantes que se trasladan de países en desarrollo a regiones prósperas demuestran un aumento rápido del asma y las enfermedades alérgicas, así como enfermedades autoinmunes como la diabetes tipo 1 y la esclerosis múltiple. Parece que las condiciones de vida doméstica, el aumento de los nacimientos por cesárea, el uso de antibióticos, las prácticas dietéticas, la urbanización y la contaminación del aire interior son factores más importantes que la higiene pública en general.
La hipótesis de la barrera, tal como se presenta aquí, incluye los mecanismos descritos por las hipótesis de la higiene, los viejos amigos y la biodiversidad. Estos incluyen el papel regulador inmunológico de los agentes infecciosos sobre la respuesta inmunitaria innata, el equilibrio TH1-TH2 y otras respuestas reguladoras inmunitarias complejas. Una vez que la barrera epitelial tiene fugas, tienen lugar múltiples mecanismos de regulación inmunitaria para suprimir la inflamación tisular en los tejidos dañados por la barrera. Algunas enfermedades alérgicas, como la rinitis alérgica, así como ciertos tipos de asma y alergias alimentarias, pueden tratarse con inmunoterapia específica a alérgenos, que induce células T y B reguladoras y suprime la inflamación en los tejidos dañados por la barrera. Uno puede preguntarse por qué las enfermedades que se relacionan con barreras epiteliales defectuosas pueden mostrar manifestaciones clínicas muy diferentes. Sin embargo, dado que el daño epitelial puede ocurrir en ubicaciones anatómicas muy diferentes y al considerar la complejidad de la microbiota y la disbiosis microbiana, así como la complejidad de las respuestas inmunes y la regulación inmunológica, no es sorprendente que las consecuencias del daño epitelial puedan desempeñar un papel en muchas enfermedades diferentes.
La hipótesis de la barrera sugiere la necesidad de evitar los desencadenantes ambientales y justifica más estudios sobre los niveles seguros de exposición a sustancias con potencial dañino como detergentes inhalados e ingeridos, ingestión de alimentos procesados que contienen emulsionantes, exposición a partículas, gases de escape de diésel, microplásticos y ciertas nanopartículas. Como dijo Paracelso en 1493, “sola dosis facit venenum”, todas las sustancias son venenos, todo tiene el potencial de volverse tóxico, sólo depende de la dosis. Se recomienda que los pacientes con las enfermedades crónicas no transmisibles enumeradas en la Tabla 1 eviten la exposición a estas sustancias (Tabla 3).
Es necesario continuar la investigación sobre la barrera epitelial para avanzar en la comprensión de los factores y mecanismos moleculares asociados con las “barreras con fugas”. Se deben desarrollar y validar modelos experimentales para monitorear el tráfico de antígenos ambientales a través de una barrera epitelial con fugas; esto informará los enfoques para la prevención, la intervención temprana y el desarrollo de nuevos enfoques terapéuticos. Las posibles estrategias para reducir las enfermedades asociadas con una barrera epitelial alterada incluyen evitar y controlar la dosis de todos los productos mencionados con anterioridad, el desarrollo de productos más seguros y menos tóxicos, el descubrimiento de biomarcadores para la identificación de individuos con una barrera con fugas, el desarrollo de nuevos enfoques terapéuticos para fortalecer las moléculas de barrera específicas de los tejidos, así como otros componentes de la barrera de la mucosa, bloquear la translocación bacteriana, evitar la colonización de patógenos oportunistas e intervenciones por medio de la dieta y el microbioma.
Akdis, C.A. Does the epithelial barrier hypothesis explain the increase in allergy, autoimmunity and other chronic conditions?. Nat Rev Immunol 21, 739–751 (2021). https://doi.org/10.1038/s41577-021-00538-7
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dr. Carlos Macouzet Sánchez Profesor
Dra. Grecia Jaqueline Hernández Salcido Residente 1er Año
Dra. Alejandra Macías Weinmann Profesor




No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.