Introducción
Existe una creciente evidencia de que el SARS-CoV-2 no solo afecta el tracto respiratorio sino que también afecta el SNC, lo que resulta en síntomas neurológicos como pérdida del olfato y el gusto, dolor de cabeza, fatiga, náuseas y vómitos en más de un tercio de las personas con COVID-19.
Además, se han notificado enfermedades cerebrovasculares agudas y alteración de la conciencia. Si bien estudios recientes han descrito la presencia de ARN viral en el cerebro y el líquido cefalorraquídeo (LCR), no han tenido pruebas de una infección genuina por SARS-CoV-2. Por lo tanto, no se ha realizado un análisis sistemático de los cerebros de las autopsias y los tejidos periféricos destinados a comprender el puerto de entrada y distribución del SARS-CoV-2 dentro del SNC.
Actualmente, existen siete tipos de coronavirus (CoV) que infectan de forma natural a los seres humanos y, de estos, se ha demostrado que al menos dos cepas endémicas entran y persisten en el SNC. En un estudio de autopsia, el 48% de los casos investigados portaban ARN de CoV humano detectable en el SNC. Además, el potencial neuroinvasivo del SARS-CoV y el síndrome respiratorio de Oriente Medio (MERS) -CoV, que están estrechamente relacionados evolutivamente con el SARS-CoV-2, se ha descrito previamente.
Se sabe que el SARS-CoV, incluido el SARS-CoV-2, ingresa a las células huésped humanas principalmente al unirse al receptor celular de la enzima convertidora de angiotensina 2 (ACE2) y mediante la acción de la serina proteasa TMPRSS2 para el cebado de la proteína pico (S ). La evidencia de apoyo proviene de estudios en animales que demuestran que el SARS-CoV es capaz de ingresar al cerebro tras la infección intranasal de ratones que expresan ACE2 humana.
En el pulmón, las células secretoras transitorias bronquiales expresan ACE2 y TMPRSS2. De manera similar, existe evidencia de la expresión de ACE2 en células neuronales y gliales en el SNC humano. En la mucosa olfativa humana, se demostró que ACE2 se expresa por células no neuronales en condiciones fisiológicas, mientras que se sabe poco sobre la expresión de ACE2 en un entorno inflamatorio o séptico.
Debido a que el conocimiento del neurotropismo del SARS-CoV-2 y los posibles mecanismos de entrada al SNC y distribución viral es clave para una mejor comprensión del diagnóstico de COVID-19, el pronóstico y las medidas de intervención, evaluamos la mucosa olfativa, sus proyecciones nerviosas y varias regiones definidas del SNC en 33 personas que murieron en el contexto de COVID-19.
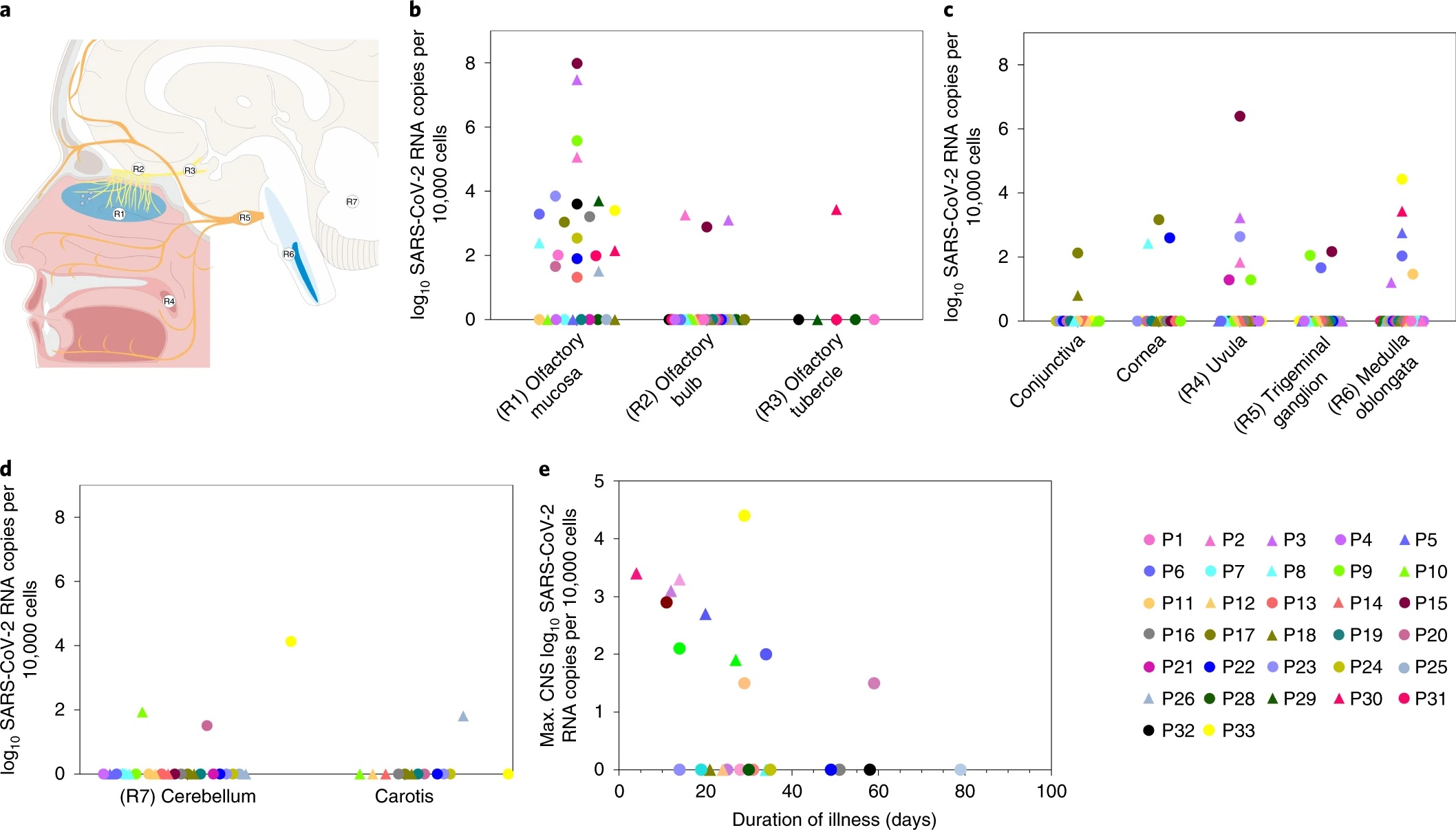
Detección de SARS-CoV-2 en personas fallecidas con COVID-19 en regiones orofaríngeas y nasofaríngeas y del SNC cartografiadas anatómicamente de forma distinta.
Discusión
Varios estudios recientes basados en tejidos que evalúan las alteraciones del SNC en el COVID-19 mortal han proporcionado los primeros indicios de los cambios histopatológicos que se producen en el COVID-19, como la patología relacionada con la hipoxia, incluido el infarto del SNC debido a tromboembolismo cerebral y los signos de una respuesta de células mieloides intrínsecas al SNC y / o han presentado datos sobre la presencia de ARN viral en el SNC.
Para ampliar el conocimiento existente y proporcionar más pruebas de la presencia y distribución de SARS-CoV-2 en la mucosa olfatoria y dentro del SNC, visualizamos el ARN viral y las proteínas utilizando técnicas de tinción inmunohistoquímica y de ISH. Esto nos permitió diseccionar las células que albergan el virus y arrojar luz sobre el mecanismo de entrada del SNC del SARS-CoV-2 en la interfaz neural-mucosa en la mucosa olfatoria. También pudimos visualizar partículas de CoV intactas a nivel ultraestructural.
Estos datos a menudo se malinterpretan, especialmente cuando las conclusiones se basan únicamente en subestructuras similares a virus relativamente mal definidas. En tejidos positivos para ARN del SARS-CoV-2, encontramos la proteína S del SARS-CoV en el citoplasma de las células endoteliales, en contraste con los hallazgos de Solomon et al.; lo más probable es que los diferentes resultados se deban a diferencias metodológicas entre los protocolos de tinción utilizados. Se descubrió que la presencia de SARS-CoV-2 en el SNC da como resultado una respuesta local del SNC mediada a través de microglía HLA-DR + como efectores de una respuesta inflamatoria impulsada por mieloide. Esta respuesta inmune innata tiene una correlación en el LCR, donde se encontró que los niveles de mediadores inflamatorios estaban aumentados.
La presencia de partículas de CoV intactas junto con ARN de SARS-CoV-2 en la mucosa olfatoria, así como en áreas neuroanatómicas que reciben proyecciones del tracto olfatorio, puede sugerir una neuroinvasión de SARS-CoV-2 que se produce por transporte axonal. Sin embargo, la detección morfológica de partículas virales individuales en axones es (si es posible) muy difícil debido al muy bajo número de partículas virales que se esperan, dado que se cree que el aparato de reproducción viral está ubicado en los somas neuronales. Esta dificultad para visualizar el SARS-CoV-2 dentro del SNC a nivel celular se ve agravada aún más por el hecho de que el bulbo olfatorio es una región del SNC relativamente pequeña con un número limitado de neuronas, lo que se evidencia por la pequeña cantidad de ARN viral que se obtuvo en casos de COVID-19 que albergaban bulbos olfatorios positivos por PCR para SARS-CoV-2.
Además, la capacidad de detectar el SARS-CoV-2 también puede verse afectada por la duración de la infección por COVID-19, ya que la duración determina la carga viral en un momento y lugar determinados, y no podemos excluir la posibilidad de que el virus esté infectado. las células (neuronales) podrían morir y así evadir la detección.
Como pudimos detectar el ARN del SARS-CoV-2 en algunos individuos en regiones del SNC que no tienen conexión directa con la mucosa olfativa, como el cerebelo, pueden existir otros mecanismos o rutas de entrada viral al SNC, posiblemente además ao en combinación con el transporte axonal. Por ejemplo, no se puede excluir la migración de leucocitos portadores de SARS-CoV-2 a través de la barrera hematoencefálica (BBB) o la entrada de virus a lo largo de la endotelia del SNC. Esta última es una posibilidad válida, al menos además de una ruta presuntamente axonal, ya que encontramos inmunorreactividad a la proteína S del SARS-CoV en células endoteliales cerebrales y leptomeníngeas.
Se ha pensado que la desregulación generalizada de los sistemas cardiovascular, pulmonar y renal es una de las principales causas de enfermedad en los casos de COVID-19 graves o letales. A la luz de informes previos de infección por SARS-CoV y otros CoV en el sistema nervioso43 y nuestras observaciones de SARS-CoV-2 en el tallo cerebral, que comprende el centro primario de control respiratorio y cardiovascular, es posible que el SARS-CoV-2 la infección, al menos en algunos casos, podría agravar la insuficiencia respiratoria o cardíaca, o incluso causar insuficiencia, de una manera mediada por el SNC.
La presencia de infartos agudos en el tronco encefálico (n = 2 de 6 individuos analizados) podría apoyar esta noción. Incluso en ausencia de signos claros de distribución generalizada de SARS-CoV-2 en células neuronales o gliales del parénquima del SNC en los casos de autopsia de COVID-19 investigados aquí, el SARS-CoV-2 en el endotelio del SNC podría facilitar el daño vascular y permitir el virus se propague más ampliamente a otras regiones del cerebro con el tiempo, contribuyendo así eventualmente a un curso de la enfermedad más grave o incluso crónico, dependiendo de varios factores como la duración de la persistencia viral, la carga viral y el estado inmunológico, entre otros.
Tomando nuestros hallazgos en conjunto, proporcionamos evidencia de que la neuroinvasión del SARS-CoV-2 puede ocurrir en la interfaz neural-mucosa por entrada transmucosa a través de estructuras nerviosas regionales.
A esto le puede seguir el transporte a lo largo del tracto olfatorio del SNC, lo que explica algunos de los síntomas neurológicos bien documentados del COVID-19, incluidas las alteraciones de la percepción del olfato y el gusto. Una advertencia a tener en cuenta con los casos de COVID-19 informados aquí es el intervalo post mortem relativamente largo, un obstáculo casi insuperable en los estudios de autopsias, especialmente cuando se realizan en las condiciones similares a las de emergencia que se encuentran durante una situación de pandemia.
El análisis de estas muestras está limitado por restricciones bien conocidas resultantes de la autólisis de células y tejidos, lo que finalmente complica la interpretación de los análisis morfológicos y moleculares. A pesar de estas limitaciones, pudimos recuperar numerosos conocimientos valiosos.
Estos incluyeron la detección de partículas de CoV bien conservadas a nivel ultraestructural en un individuo con un intervalo post mórtem de 82 horas (P15) e importantes conocimientos patogénicos, lo que permitió investigaciones más detalladas y mecanicistas al tiempo que fomentaba más estudios de autopsias, incluido un muestreo amplio para permiten múltiples análisis complementarios y la aplicación de metodologías de vanguardia. Dichos estudios permitirán la identificación del mecanismo de entrada del SARS-CoV-2 celular y molecular preciso, así como los receptores en las OSN, donde las vías no neuronales también pueden tener un papel.
Fuente:




No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.