Antecedentes
El Premio Nobel de Fisiología o Medicina 2017 se otorgó a tres de los principales científicos que contribuyeron al descubrimiento de la red de genes y proteínas que regulan los ritmos circadianos basados en el ciclo de 24 horas de luz/oscuridad (“El Premio Nobel de Fisiología o Medicina 2017−Comunicado de prensa”).
Los relojes circadianos están presentes en organismos unicelulares, en plantas, insectos y vertebrados. El primer gen que codifica un componente crítico de un reloj circadiano (Período) se descubrió en la Drosophila por Konopka y Benzer en 1971, lo que demostró que los relojes circadianos se codifican de forma genética. En los mamíferos, los relojes circadianos se encuentran en casi todas las células y tejidos. Los relojes circadianos regulan y controlan los procesos fisiológicos a nivel celular, orgánico y sistémico, e integran las señales recibidas desde el exterior y generadas por el metabolismo normal. El propósito de los diferentes niveles de control es ajustar las posibles perturbaciones locales, mientras se mantiene un ritmo circadiano capaz de optimizar la asignación de energía para el escenario más probable (que difiere durante los períodos de actividad y descanso).
Por ejemplo, el reloj del hígado debe sincronizarse con los ritmos en la ingesta de alimentos, pero también debe responder a los cambios en las demandas de energía o las variaciones en el suministro de oxígeno. La organización del sistema de reloj múltiple de los mamíferos permite una mejor adaptación a ambientes variables. Esto puede representar un compromiso entre la adaptación flexible a eventos impredecibles de forma extrema y la estabilidad circadiana, que también puede distinguir los cambios de las horas de luz-oscuridad (y temperatura, humedad, etc.) con las diferentes estaciones.
Las señales de mantenimiento del tiempo (“sincronizador”) en condiciones naturales se vinculan al ciclo día-noche impuesto por el ciclo de rotación de 24 horas de la Tierra. La luz es un sincronizador del tiempo muy potente, regula el ritmo de sueño-vigilia de 24 horas. El sueño excluye la ingesta de alimentos y la actividad locomotora. Por lo tanto, el ritmo de sueño-vigilia gobernado por la luz solar impulsa de forma indirecta los ciclos de ingesta de alimentos y temperatura corporal. Sin embargo, la luz y la comida se pueden desacoplar (por ejemplo, en el caso de la descompensación horaria o cuando la ingesta de alimentos se restringe a la fase de sueño natural como en el trabajo por turnos), lo que provoca una desalineación de estos relojes con el ciclo diario de luz-oscuridad del entorno. El campo se estimuló por el hallazgo de un subgrupo pequeño de células ganglionares de la retina fotosensibles de manera intrínseca que regulan los ritmos circadianos en el ciclo de luz-oscuridad y se proyectan a los núcleos supraquiasmáticos (SCN), centros cerebrales no visuales donde se encuentra el reloj biológico maestro de los mamíferos; esto llevó a la búsqueda del reloj o los relojes moleculares que impulsan este componente esencial de todos los organismos vivos. Se identificó un grupo de genes y proteínas que explican esta compleja red central reguladora.
Relojes biológicos
El reloj molecular del núcleo de los mamíferos consta de dos bucles de retroalimentación conectados por un par central de factores de transcripción que se regulan de forma recíproca para inducir el ritmo de la expresión génica. El reloj circadiano de los mamíferos depende de manera fundamental de dos genes maestros (CLOCK y BMAL1) para dirigir la expresión génica y regular las funciones biológicas. Los heterodímeros de CLOCK:BMAL1 promueven la apertura rítmica de la cromatina y esto media la unión de otros factores de transcripción adyacentes a CLOCK:BMAL1. Entre sus objetivos hay un grupo de proteínas reguladoras [PERÍODO (PER1, 2 y 3), CRIPTOCROMO (CRY1 y 2), REV-ERB (REV-ERBa y b) y Receptor huérfano relacionado con RAR (ROR a, b y c)]; REV-ERB y ROR regulan la transcripción de BMAL1, mientras que PER y CRY se combinan para inhibir el dímero de BMAL1-CLOCK. PER, la proteína codificada por período se acumula durante la noche y se degrada durante el día, mientras que otros componentes permiten la translocación nuclear de PER. Los ciclos de sueño-vigilia y muchos ritmos de 24 horas persisten en ausencia de señales ambientales y se controlan por relojes moleculares internos.
Varios ciclos dictan la producción de estas proteínas, incluidos los pasos de acetilación y fosforilación, así como los genes regulados por reloj secundario que también pueden retroalimentarse por los genes del reloj central. De hecho, muchos órganos y tejidos diferentes expresan circuitos funcionales de reloj molecular. Ninguno de los componentes del reloj de los mamíferos es fotorreceptivo de forma directa; en cambio, las señales luminosas de la retina se transmiten de forma neuronal a factores de transcripción que regulan la expresión de período. Los circuitos de retroalimentación transcripcional son fundamentales para la generación y el mantenimiento de los ritmos circadianos. Los relojes en los tejidos periféricos utilizan de manera esencial los mismos componentes moleculares que en el SCN; se detectaron relojes en diferentes linajes de células hematopoyéticas, incluidos macrófagos y linfocitos.
El origen de los ritmos circadianos
En los humanos, los ritmos circadianos de 24 horas deben sincronizarse para coincidir con el ciclo de rotación de la Tierra. La alineación de este ritmo circadiano autónomo a un ritmo externo se define como arrastre. Los patrones de luz representan el principal estímulo ambiental para los ciclos de descanso/actividad y sueño/vigilia. También es responsable de manera indirecta de la sincronización de la ingesta de alimentos, otro potente activador del ritmo.
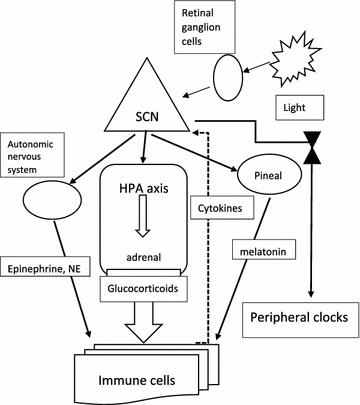
El fotoentrenamiento circadiano es el proceso mediante el cual el reloj interno en el cerebro profundo se sincroniza con el ciclo externo diario de luz solar y oscuridad. Los relojes en la mayoría de las células de mamíferos no son fotorreceptivos de manera directa, a diferencia de la mayoría de los otros organismos, sino que se atraen de forma indirecta al ciclo de luz-oscuridad ambiental por medio de la fotorrecepción en la retina, el tracto retino-hipotalámico y un tejido de marcapasos central en el núcleo supraquiasmático del hipotálamo (SCN). Este proceso se inicia por un tipo de células ganglionares de la retina que envían proyecciones axonales al SCN, la región del marcapasos circadiano (Fig. 1). A diferencia de las células retinianas que median la visión, estas células son sensibles de forma intrínseca a la luz, de manera independiente de la entrada sináptica de los fotorreceptores de bastones y conos. El fotoentrenamiento del marcapasos maestro requiere la transmisión de señales de las células ganglionares de la retina que contienen el fotopigmento melanopsina y son fotosensibles de forma intrínseca. La familia de fotorreceptores criptocromos/fotolásicos media las respuestas adaptativas a la exposición a la luz ultravioleta y azul en todas las formas de vida. De manera posterior, el SCN sincroniza los relojes periféricos por medio de mediadores que incluyen hormonas y señales neuronales, que usan principalmente el eje hipotálamo-hipófisis-suprarrenal (HPA) y el sistema nervioso autónomo. Las principales hormonas, es decir, los glucocorticoides y las catecolaminas (epinefrina y norepinefrina), se liberan por la glándula suprarrenal mediante el eje HPA, pero la norepinefrina también se deriva de terminaciones nerviosas simpáticas. El HPA se controla por el SCN, que se proyecta hacia el núcleo paraventricular del hipotálamo, y esto a su vez induce la liberación de la hormona adrenocorticotrópica por la hipófisis, y así regula la glándula suprarrenal. Las catecolaminas actúan por medio de los receptores adrenérgicos, que tienen muchos efectos sobre las células inmunitarias, además de aumentar las respuestas inmunes humorales.
El sistema circadiano integrado
El sistema biológico central CLOCK, influenciado por los cambios de luz/oscuridad, “crea” los ritmos circadianos internos, y el organismo “siente” estos cambios para poner actividades físicas en el marco, incluido el metabolismo energético, el sueño y la función inmunológica.
Una revisión reciente enumeró las siguientes condiciones patológicas que muestran patrones diurnos o de 24 horas, por el órgano/tejido/sistema afectado, piel: dermatitis atópica, urticaria, psoriasis e hiperhidrosis palmar; gastrointestinal: reflujo esofágico, úlcera péptica, cólico biliar, hemorragia de varices hepáticas y proctalgia; infección: susceptibilidad, fiebre y mortalidad; neural: convulsiones del lóbulo frontal, parietal, temporal y occipital, enfermedad de Parkinson y Alzheimer, distonía hereditaria progresiva y dolor (cáncer, neuropatía postquirúrgica, diabética, ardor de boca y síndromes temporomandibulares, fibromialgia, neuropatía ciática y migraña, cefalea); renal: cólico, enuresis nocturna y poliuria; ocular: enrojecimiento conjuntival, queratoconjuntivitis sicca, presión intraocular, neuropatía óptica isquémica anterior y síndrome de erosión corneal recurrente; psiquiatría/comportamiento: trastornos depresivos afectivos mayores y estacionales, trastorno bipolar, suicidio y fenómenos de abstinencia y adicción al alcohol, el tabaco y la heroína; autoinmune y musculoesquelético: artritis reumatoide, osteoartritis, espondiloartritis axial, gota, síndrome de Sjögren y lupus eritematoso sistémico. Algunos se relacionan de forma directa con la interrupción de los ritmos circadianos, otros dan como resultado un sueño perturbado con pérdida del ritmo; los relojes periféricos en diferentes tejidos quedan fuera de fase con el regulador central y otras funciones fisiológicas, lo que a su vez agrava los síntomas y altera el cuadro clínico.
Relevancia para las funciones inmunológicas
Una gama amplia de parámetros inmunitarios, como el número de células mononucleares de sangre periférica y el nivel de citocinas, sufren fluctuaciones diarias. El número total de células madre hematopoyéticas y la mayoría de los leucocitos maduros alcanzan su punto máximo en la circulación durante la fase de reposo (durante la noche para los humanos) y disminuyen durante el día. La mayoría de las células inmunitarias expresan los genes del reloj circadiano y presentan una gama amplia de genes que se expresan con un ritmo de 24 horas. Además de sus funciones en el reloj celular, los osciladores circadianos también participan en el desarrollo y la especificación de las líneas celulares inmunitarias. Esto tiene impacto profundo en las funciones celulares, como un ritmo diario en la síntesis y la liberación de citocinas, quimiocinas y factores citolíticos, la activación diaria de la respuesta se produce por medio de receptores de reconocimiento de patrones, ritmos circadianos de funciones celulares como fagocitosis, migración a tejidos con infección o inflamación, actividad citolítica y respuesta proliferativa a antígenos. Halberg realizó una contribución pionera en esta área, descubrió un patrón de susceptibilidad diurno en ratones expuestos a endotoxinas bacterianas. La migración de las células hematopoyéticas a los tejidos ocurre de forma preferente durante el día, dirigida por la expresión circadiana de moléculas de adhesión celular y quimiocinas. Durante la fase activa es más probable que encuentre y detecte patógenos y el tráfico de leucocitos en los tejidos se produce al comienzo de esta fase (temprano en la mañana). Por lo tanto, el aumento de la liberación de citocinas en este momento puede exacerbar cualquier inflamación local en curso. Uno de los mecanismos por medio de los cuales el reloj central entrena los tejidos periféricos es la producción de glucocorticoides en la glándula suprarrenal. Muchos otros mediadores de transducción de señales circadianas también regulan la respuesta inmunitaria, como la melatonina y el sistema nervioso autónomo (Fig. 1).
La perturbación del ritmo redox (vinculado al reloj circadiano) inducida por el desafío patógeno activa los genes de defensa inmunitaria sin comprometer el reloj circadiano. La activación de la inmunidad innata por medio de TLR4 induce una inflamación sistémica y provoca respuestas transcripcionales neuroendocrinas y leucocitarias, que se regulan por el reloj circadiano e impone el ritmo diurno de la respuesta inflamatoria. El reloj central es sensible al desafío inmunitario y el cerebro recibe señales inflamatorias de la periferia en respuesta a una lesión/infección.. Esto, a su vez, se cree que agrava la enfermedad, desarrolla síntomas como la depresión y altera los ritmos diurnos de la temperatura y la secreción de melatonina. La melatonina, secretada por la glándula pineal bajo el control del SCN, desempeña un papel importante en la regulación inmunitaria; la pinealectomía causa una inmunosupresión extensa, probablemente mediada por la disminución de linfocitos y citocinas como la IL-2, la IL-12 y el TNF-α.
El sueño y las influencias de la luz
El tiempo y la duración del sueño se controlan de manera estrecha por mecanismos centrales. Estos pueden interrumpirse por procesos de la enfermedad, pero también por otras condiciones externas, como los turnos de noche, los viajes de vuelo de largo alcance (descompensación horaria) y la actividad social nocturna (descompensación horaria social). Las citocinas proinflamatorias se catalogan como inductoras de sueño, y los niveles plasmáticos basales de estas citocinas aparecen más altos durante la fase de reposo. La somnolencia asociada a la infección se atribuye al aumento de los niveles plasmáticos de las citocinas proinflamatorias.
La restricción del sueño a largo plazo conduce a un aumento gradual de los leucocitos circulantes y subpoblaciones (neutrófilos, monocitos y linfocitos) con alteraciones en el número y el ritmo de los neutrófilos que persisten después de 1 semana de recuperación del sueño; además, la falta absoluta de sueño altera el ritmo de los granulocitos. Los trastornos del sueño son uno de los síntomas más comunes en pacientes con VIH/SIDA, pero a pesar de la alteración del ritmo circadiano inducida por la proteína tat del VIH en los pacientes infectados por el VIH con mayores concentraciones de la proteína tat tienen una mejor calidad de sueño, es probable que sea porque aumenta la producción de melatonina, que contrarresta la mala calidad del sueño inducida por el VIH. En el espectro opuesto de los trastornos del sueño, la narcolepsia, que en general se considera una enfermedad neurológica mediada por el sistema inmunitario caracterizada por somnolencia diurna excesiva, se caracterizó de manera reciente por un aumento de la producción de citocinas inflamatorias y marcadores de activación de células B y T diferente a otros pacientes con hipersomnia que eran de características inmunitarias distintas y no presentaban aumento de citocinas plasmáticas. Muchas funciones inmunitarias dependen de la influencia del sueño en los ritmos circadianos, y la pérdida de sueño, a su vez, altera la producción de glucocorticoides durante la noche. La respuesta inmunitaria neuroendocrina del eje HPA y el sistema nervioso simpático, que se activa en respuesta a un desafío antigénico, con una actividad inflamatoria transitoria, puede conducir a enfermedades metabólicas cuando se activa de forma crónica, ya que en todas las condiciones inflamatorias tienen que proveerse cantidades grandes de energía para el sistema inmunitario activado. Los modelos animales experimentales y los datos epidemiológicos indican que la interrupción crónica del ritmo circadiano aumenta el riesgo de enfermedades metabólicas.
En los pacientes con artritis reumatoide (AR), la inflamación es una covariable importante para la interferencia del sueño y el eje HPA. Además, la interrelación entre los parámetros del sueño, la inflamación evidenciada por la proteína C reactiva y el cortisol sérico y los niveles de hormona adrenocorticotrópica. El conocimiento de los ritmos circadianos y la influencia de los glucocorticoides en la reumatología es importante: además de optimizar el tratamiento para los síntomas centrales (por ejemplo, la rigidez matutina en la AR), la cronoterapia también puede aliviar importantes condiciones comórbidas como la depresión y los trastornos del sueño. El sueño y los trastornos circadianos son una queja frecuente de los pacientes con enfermedad de Alzheimer, ya que aparecen temprano en el curso de la enfermedad, y la alteración de muchos ritmos circadianos también está presente en la enfermedad de Parkinson.
Los estudios fisiológicos muestran que el envejecimiento afecta tanto a la calidad como a la cantidad del sueño en humanos, y las quejas del sueño aumentan con la edad. Por otra parte, también se comprometen los ritmos de alimentación/ayuno.
La expresión circadiana de las moléculas de transmisión de señales secretadas transmite información sincronizada entre las células y los tejidos. Los ritmos diarios optimizan el uso de energía y segregan de forma temporal los procesos incompatibles.
Los pacientes que sufren trastornos neuropsiquiátricos a menudo exhiben una pérdida de regulación de sus ritmos biológicos que conduce a alteraciones del sueño/vigilia, la alimentación, la temperatura corporal y los ritmos hormonales. La evidencia creciente indica que el sistema circadiano puede involucrarse de forma directa en la etiología de estos trastornos.
La luz, en especial la luz azul de longitud de onda corta es la señal ambiental más potente en el fotoentrenamiento circadiano y se cree que el envejecimiento de la lente influye en este evento al actuar como un filtro para longitudes de onda azules más cortas; las condiciones de la luz durante las actividades en interiores, así como la exposición a la luz solar, son de suma importancia para preservar el ritmo circadiano y evitar un factor de riesgo para varias enfermedades crónicas. Estas consideraciones influyen en las comorbilidades de los sujetos de edad avanzada y en la importancia de la elección de las propiedades diferenciales de filtración de luz de las lentes intraoculares después de la extracción de cataratas.
Relojes biológicos y enfermedades alérgicas
Como una adición importante a las muchas consecuencias para la salud de las anomalías de los ritmos circadianos integrados, hay que mencionar los trastornos en el metabolismo de la glucosa y los lípidos como inductores de la obesidad y el desarrollo de diabetes tipo 2 y los efectos multifacéticos del control circadiano del sistema inmunitario y su activación. Estos hallazgos resaltan el papel integrador de los ritmos circadianos en la fisiología.
La mayoría de los estudios se ocupan del asma, donde los síntomas experimentan variaciones circadianas con exacerbaciones que ocurren con mayor frecuencia durante la noche (Tabla 1). El asma nocturna es una presentación común y se asocia con una forma más grave de la enfermedad. Las enfermedades de las vías respiratorias se asocian con ritmos circadianos anormales de la función pulmonar, que se reflejan en los cambios diarios del calibre de las vías respiratorias, la resistencia de las vías respiratorias, los síntomas respiratorios y las respuestas inmunes inflamatorias. El reloj molecular se altera por el humo del cigarrillo, LPS y las infecciones bacterianas y virales en los pulmones de ratones y humanos y en pacientes con enfermedades crónicas de las vías respiratorias. En pacientes con asma nocturna, la diferencia en el FEV1 (y la tasa de flujo espiratorio máximo) entre el día y la noche puede ser mayor a 15%. También la variación diurna de FeNO en los pacientes con asma no controlados fue mayor de forma significativa que en los pacientes con asma controlada. El grado de control del asma correlaciona de forma fuerte con la calidad del sueño. Las personas con asma no controlada tardaron más en conciliar el sueño, se despertaron más a menudo y pasaron más tiempo despiertas durante la noche en comparación con las personas con asma bien controlada. El mal control del asma, el uso de medicamentos de rescate y los síntomas del asma se asocian con somnolencia diurna y limitaciones en la actividad física y la función emocional. En un estudio de campo que subdividió a los pacientes según el tiempo preferido para la actividad (cronotipos), 35% de los pacientes con asma presentaron síntomas nocturnos y el cronotipo matutino estuvo subrepresentado en comparación con los pacientes con asma sin síntomas nocturnos. La sincronización de los tratamientos farmacológicos en el asma (cronoterapia) se rige por la naturaleza circadiana del asma. El reloj periférico dentro del pulmón se localiza en la célula clara del epitelio bronquial del ratón. Las oscilaciones cíclicas en la expresión de genes asociados con la matriz extracelular, el citoesqueleto, el ciclo celular y la apoptosis, sugieren que la reparación y el recambio de estos componentes en el pulmón están de forma directa o indirecta bajo la regulación del reloj molecular del pulmón. No existe un modelo animal de asma con alteraciones de los ritmos circadianos debido a las mutaciones de los componentes del reloj molecular. Sin embargo, de manera reciente, en ratones que carecen de expresión de BMAL1 en células mieloides, la inducción de asma causó una inflamación aumentada de manera notable en los pulmones, con mayor número de eosinófilos y aumento de los niveles de IL-5 en el pulmón y en el suero. Además, el ARNm del factor estimulante de colonias de granulocitos y macrófagos, expresado por eosinófilos activados, se triplicó en la madrugada en comparación con la tarde en los eosinófilos circulantes de pacientes con asma con síntomas nocturnos, pero no en aquellos sin síntomas. En conjunto, todos los datos indican que la cronoterapia del asma ofrece mayores posibilidades de lograr el control de los síntomas, y en particular los que se desarrollan durante la noche, como en la mayoría de las otras enfermedades alérgicas.
También en la rinitis alérgica, los síntomas suelen ser más graves durante la noche o temprano en la mañana, y la expresión inducida por alergeno de CD203c en la superficie de los basófilos de pacientes con rinitis alérgica estacional presenta una variación que depende de la hora del día. La reactividad de los basófilos muestra variaciones diarias de acuerdo con la actividad del reloj circadiano en los basófilos, lo que podría explicar en parte las variaciones sintomáticas temporales en la rinitis alérgica. Se encontró que los ritmos circadianos de la melatonina salival y el cortisol se alteran en pacientes con rinitis alérgica. El deterioro del sueño es muy común en pacientes con rinitis alérgica y tiene un impacto significativo en las medidas específicas de la enfermedad de salud general y calidad de vida. El grado de alteración del sueño se relaciona de manera directa con la gravedad de la enfermedad. Los esteroides intranasales causan un cambio en el tiempo del ritmo PER2 en la mucosa nasal del ratón alrededor del pico de los glucocorticoides séricos, lo que sugiere que el ritmo circadiano de los glucocorticoides endógenos regula el reloj periférico nasal (Tabla 1). Esto debería implicar que en los humanos se deben administrar esteroides cuando no se puede inducir un cambio en el tiempo, es decir, temprano en la noche.
En el caso del eccema atópico, la alteración del sueño afecta hasta 60% de los niños, y aumenta aún más durante las exacerbaciones. Esto puede afectar las actividades diurnas y llevar a alteraciones del comportamiento. La evaluación de la calidad del sueño debe representar el parámetro relevante para el control de la actividad de la enfermedad, en particular en pacientes que sufren de empeoramiento de los síntomas durante la noche. En los ratones, la interrupción del ritmo biológico provoca la exacerbación de la hipersensibilidad al contacto, probablemente debido a la alteración del ritmo de los glucocorticoides. El sueño y la interferencia en la actividad diaria se consideran indicadores importantes para evaluar la actividad de la enfermedad y la calidad de vida en la urticaria crónica espontánea, y un estudio internacional reciente de observación sobre la calidad de vida concluyó que la urticaria crónica espontánea interfería de forma notable con el sueño y las actividades diarias. Estudios previos revelaron variaciones circadianas de los niveles de histamina, que alcanzan un máximo a las 2 a.m. en la mastocitosis, pero sin cambios diurnos en el número de basófilos, aunque la basopenia se encuentra a menudo en la urticaria crónica.
Se demostró que los relojes circadianos controlan los ritmos diarios de las reacciones alérgicas mediadas por IgE en la piel de los ratones. También las reacciones anafilácticas sistémicas muestran una variación diurna, que se basa en los relojes circadianos; de forma breve, el reloj circadiano es un potente regulador de la fuerza de las reacciones alérgicas dependientes de IgE en la piel, pero también en otros órganos diana. Todavía falta un enlace mecanístico, mientras que los hallazgos experimentales sugieren que Clock es un regulador de la inflamación cutánea similar a la psoriasis en ratones por medio de la modulación directa de IL 23R. En la Tabla 1 se muestran ejemplos representativos de los ritmos circadianos de los síntomas y mediadores moleculares de las enfermedades alérgicas inmunológicas.
Conclusión
El Premio Nobel de Fisiología o Medicina 2017 centró la atención en la importancia de la homeostasis y la distribución equilibrada de los recursos energéticos garantizados por la presencia de ritmos circadianos. Estos se controlan de forma central por el reloj maestro en el SCN y se fotoentrenan en el ciclo de luz-oscuridad por medio de las entradas de las células ganglionares de la retina que contienen melanopsina. Los relojes circadianos no se construyen en un esquema rígido de arriba hacia abajo, lo que permite oscilaciones de los relojes periféricos en diferentes células y tejidos, y maximizar así la flexibilidad y la adaptación a los cambios en el medio ambiente y en el organismo. A nivel bioquímico, consisten en ciclos de retroalimentación acoplados que establecen un oscilador molecular ajustable y autosostenido que controla, por medio de programas transcripcionales, un espectro amplio de procesos celulares y orgánicos. Muchos eventos fisiológicos, desde el sueño hasta la alimentación, así como la capacidad de respuesta inmunitaria, se vinculan a los ritmos circadianos. Su interrupción puede tener efectos profundos en la fisiología; la sociedad y el estilo de vida modernos ponen cada vez más presiones para empujar la actividad y dormir fuera de sincronía con el ritmo circadiano, como en el trabajo y los hábitos alimenticios. Esto representa una amenaza adicional para las condiciones de salud de los trabajadores en el turno nocturno, o que están sujetos a viajes de larga distancia por medio de muchas zonas horarias (descompensación horaria) o trabajan en condiciones de luz artificial que imita la luz solar, pero con el peligro derivado de los LED y pantallas LED con gran cantidad de luz azul. Por último, la importancia emergente de la cronoalimentación (para evitar las epidemias de obesidad y trastornos cardiometabólicos asociados) y la cronofarmacología impone cambios en las prácticas estándar actuales que tienen poca consideración por los ritmos circadianos.
Review - Open Access
Biological clocks: their relevance to immune-allergic diseases
Roberto Paganelli, Claudia Petrarca and Mario Di Gioacchino
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Rosalaura Virginia Villarreal González Profesor
Dra. Gehnssy Karolina Rocha Silva Residente 1er Año
Dra. Alejandra Macías Weinmann Profesor



No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.