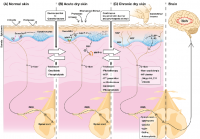
La piel, el órgano más grande del cuerpo, sirve como primera barrera fisiológica contra el entorno externo. La función de barrera de la piel se ejerce por la epidermis, la capa más superficial de la piel, de la cual el estrato córneo (EC) es en gran parte responsable de la función de barrera. Hay 2 elementos importantes para el mantenimiento de la humedad del EC: los lípidos intercelulares, que forman la barrera principal contra la difusión del agua a través del EC, y el factor de humectación natural, que tiene un papel clave en la absorción de agua en el EC. La integridad de la barrera cutánea deteriorada causa una pérdida excesiva de agua y provoca sequedad de la piel.
PIEL SECA
La piel seca se caracteriza por una superficie escamosa, áspera, agrietada y fisurada, y se asocia de forma estrecha con la sensación somatosensorial del prurito, en especial el prurito crónico. La piel seca con prurito crónico es la manifestación clínica más común de dermatosis, como xerosis, dermatitis atópica (DA) y psoriasis, y es una manifestación cutánea común en enfermedades sistémicas pruríticas, como la enfermedad renal crónica (ERC), enfermedades hepáticas crónicas (EHC) y la diabetes mellitus (DM).
La histamina es una sustancia bien conocida que induce prurito; sin embargo, los antihistamínicos (bloqueadores del receptor H1 de la histamina) no son efectivos por completo en muchas enfermedades dermatológicas y sistémicas caracterizadas por piel seca, lo que sugiere que la piel seca es una característica importante del prurito resistente a la histamina (independiente de la histamina). La condición subyacente de la piel seca es la función deteriorada de la barrera cutánea, causada por factores ambientales, como la exposición al sol, la temperatura, la humedad y factores genéticos, como las mutaciones de la filagrina. Para evaluar la función de la barrera cutánea, se utilizan por lo común la pérdida transepidérmica de agua (PTEA), la hidratación del EC y el pH. Los signos y las manifestaciones clínicas de la piel seca no sólo son incómodos de forma física, sino que también afectan de manera psicológica a los pacientes.
Piel seca relacionada con enfermedad
Piel envejecida. La xerosis es una de las afecciones de piel seca más prevalentes en la población de edad avanzada en todo el mundo, afecta a más de 50% de los individuos ≥65 años. Múltiples cambios en la piel en los ancianos se relacionan con la xerosis: (i) alteraciones en la función de barrera del EC, como cambios en la matriz lipídica celular e intercelular; (ii) variaciones del pH; (iii) alteraciones en las proteasas del EC; (iv) actividad reducida de las glándulas sebáceas y sudoríparas; y (v) disminución de los niveles de estrógeno. Todos estos factores conducen a la inducción de prurito.
Enfermedades inflamatorias de la piel. El prurito en la piel seca es un síntoma común en las dermatosis caracterizadas por la disfunción de la barrera cutánea, como la DA y la psoriasis. En estas enfermedades, los pruritógenos, como las citocinas y los mediadores químicos, se liberan del área afectada. Los pruritógenos inducen prurito de manera principal al actuar sobre los nervios sensoriales, y el área afectada se rasca, luego se agrava aún más la dermatitis. Este círculo vicioso se llama “ciclo de prurito-rascado”. La hiperestesia de la piel (una afección de la piel que implica un aumento anormal de la sensibilidad a los estímulos) ocurre en la inflamación, como la DA. El alargamiento del nervio sensorial en la epidermis de forma inmediata debajo del EC, debido a la sequedad y la inflamación, se considera una causa de hiperestesia de la piel. El factor de crecimiento nervioso (FCN), la amfirregulina (AR) y la artemina (ARTN), que son factores de alargamiento nervioso (FAN) y la semaforina 3A (Sema3A, un factor de repulsión nerviosa [FRN]), se relacionan con este alargamiento nervioso y las exacerbaciones de la DA.
De forma más reciente, Pogatzki-Zahn y colaboradores reportaron hiperestesia cutánea en pacientes con prurito crónico, como la DA, pero no se relacionó con la hiperinervación en la epidermis, observada como una disminución en el número de nervios cutáneos que cruzan la membrana basal. Los autores especularon que, aunque se redujeron los nervios que cruzan la membrana basal, es posible un aumento de los brotes intraepidérmicos de los nervios. Otra posibilidad es que la densidad, la estructura y las propiedades funcionales de los nervios intraepidérmicos fluctúen en diferentes estados de enfermedad de la piel, en especial en fases agudas y crónicas.
Enfermedades sistémicas. La piel seca también es una manifestación cutánea común en las enfermedades pruriginosas internas, como la ERC, la EHC y la DM. La sequedad de la piel puede aparecer en diferentes etapas de la ERC, pero se diagnostica con mayor frecuencia en sujetos en diálisis (45%). Las anormalidades funcionales de las glándulas sudoríparas ecrinas pueden explicar, al menos en parte, la piel seca en pacientes urémicos. Se sugirió que la piel seca puede causar prurito en la ERC; sin embargo, las mediciones objetivas de la función de barrera de la piel, como el grado de hidratación de la piel, las anormalidades de la bicapa lipídica y la sequedad de la piel, no siempre se correlacionan con el prurito.
La patogenia del prurito en la EHC es poco conocida y a menudo refractaria al tratamiento, con una prevalencia de 40.3%. Se involucran varias sustancias potenciales que causan prurito, como sales biliares, opioides endógenos, histamina, serotonina y esteroides. De forma reciente se reportó que el nivel plasmático de dinorfina A de opioides endógenos se correlaciona con la gravedad del prurito y puede reflejar su grado en pacientes con EHC.
Los trastornos de la piel son complicaciones comunes y comprenden un amplio espectro de trastornos en la DM tipo 1 y tipo 2, por ejemplo, infección cutánea, piel seca y prurito. Las observaciones clínicas se respaldan por una hidratación reducida del EC y una actividad reducida de las glándulas sebáceas en pacientes con DM. Incluso en ausencia de piel seca aparente de forma clínica, los pacientes con diabetes tienen un proceso deteriorado de descamación. El prurito es más común en pacientes con diabetes que tienen piel seca o neuropatía diabética. Se reportó que los niveles de glucosa posprandiales más altos daban como resultado una mayor probabilidad de tener prurito generalizado.
Modelos múridos de piel seca
Modelo tratado con acetona (modelo de piel seca aguda sin prurito). Un modelo de ratón para inducir la piel seca utiliza la aplicación de acetona. El pelo de los ratones se afeita sobre la parte rostral de la espalda al menos 3 días antes del tratamiento con acetona. El área afeitada se trató con bolas de algodón empapadas en acetona durante 5 minutos. En el grupo de control, el área afeitada se trató con agua estéril.
Los análisis de animales experimentales tratados con acetona demostraron que los factores relacionados con la inervación intraepidérmica, como la expresión del gen FCN y ARTN, aumentaron en la epidermis, y la restauración artificial de la barrera de forma inmediata después de la interrupción de la barrera por el tratamiento con acetona inhibió el aumento de estos niveles de ARNm. Otros observaron la liberación de histamina de las células cebadas en la piel de ratones tratados con acetona. Se descubrió que los ratones tratados con acetona mostraron un aumento rápido de PTEA y una disminución de la hidratación del EC durante la primera hora después del tratamiento, que volvió a la normalidad 48 horas después del tratamiento. Por lo tanto, los ratones tratados con acetona manifiestan las características de la piel seca y tienen permeabilidad alterada de la barrera cutánea. No se observaron comportamientos de rascado o hiperplasia epidérmica en los ratones tratados con acetona, aunque hubo un aumento en la densidad de la fibra nerviosa en la epidermis (Fig. 1A). Es de notar que se encontró que aumentó la expresión de FCN y AR epidérmicos (que promueven el crecimiento nervioso), pero disminuyó la expresión de Sema3A (que inhibe el crecimiento nervioso) antes de la penetración de las fibras nerviosas en la epidermis (Fig. 1B y C). El aumento de las fibras nerviosas intraepidérmicas es un factor importante para la regulación del prurito en la piel seca.
Modelo tratado con acetona/éter/agua (AEA) (modelo de piel seca crónica con prurito).. El modelo múrido tratado con AEA es uno de los más conocidos para el estudio del prurito inducido por la piel seca. El pelo de los ratones se afeitó sobre la parte rostral de la espalda al menos 3 días antes del inicio del experimento. Para romper la barrera cutánea, se colocó algodón (2 x 2 cm) empapado en una mezcla de acetona y éter (1:1) en el área afeitada durante 15 segundos. Después del tratamiento con AE, se colocó algodón empapado con agua destilada en la misma área durante 30 segundos. Los tratamientos se realizaron dos veces al día bajo anestesia con éter durante 5-7 días consecutivos. La PTEA y el comportamiento de rascado aumentaron, y la hidratación del EC disminuyó, bajo este tratamiento. El análisis histopatológico mostró que los ratones tratados con AEA tenían hiperplasia epidérmica marcada, paraqueratosis e infiltración de fibras nerviosas en la epidermis, pero no infiltración de células inflamatorias en la dermis. En general, el tratamiento con AEA produce una disfunción marcada de la barrera cutánea, un rascado importante y cambios en la expresión génica en los nervios sensoriales y la piel, que ejemplifican los síntomas de piel seca presentes en muchas afecciones con prurito crónica en los humanos. No hubo diferencia aparente en el rascado espontáneo inducido por AEA entre ratones con deficiencia de células cebadas (WBB6F1-W/WV) y compañeros de camada normales (WBB6F1-+/+).
Este modelo de piel seca también exhibe aloknesis (comportamiento de rascado evocado por un estímulo que por lo general no es pruriceptivo) e hiperknesis (el estado pruriceptivo anormal, en el que un estímulo prurítico de forma normal provoca prurito con una duración y/o magnitud mayor a la normal), como se describe más adelante en esta revisión.
Modelo de alimentación dietética especial. Los ratones sin pelo HR-1 alimentados con una dieta especial (HR-AD) es uno de los modelos de ratones experimentales basados en piel seca. Los ratones se alimentaron con HR-AD durante 48 días. Estos ratones exhibieron síntomas graves de piel seca acompañados de una disminución en la capacidad de retención de agua de la piel, un aumento de PTEA y una duración prolongada del rascado. Se observa una hiperplasia epidérmica marcada y un aumento en las células T circulantes y la IgE sérica. El análisis de la composición lipídica reveló que HR-AD es una dieta deficiente en ácidos grasos esenciales (AGE). La alimentación con AGE inhibe los síntomas de la piel seca. Se reportó que la deficiencia de AGE deprime la función de barrera de la piel debido a cambios estructurales en las ceramidas, y reducción de elaboración y depósito de los lípidos intercelulares epidérmicos. Por lo tanto, HR-AD provoca el deterioro de la función de barrera de la piel debido a la deficiencia de AGE.
MECANISMOS DEL PRURITO EN LA PIEL SECA
La sensación de prurito se genera mediante la unión de sustancias inductoras de prurito a sus receptores afines en aferentes sensoriales periféricos, por ejemplo, fibras aferentes C no mielinizadas y fibras aferentes Aδ mielinizadas de forma fina. El potencial evocado de acción se transmite por medio de la vía sensorial ascendente a la corteza somatosensorial, lo que resulta en la percepción de prurito (Fig. 2).
Neuronas sensoriales
Elongación nerviosa y factores de repulsión. En la piel sana, la mayoría de las fibras nerviosas cutáneas terminan debajo de las uniones dermoepidérmicas. Se observa un aumento de la densidad nerviosa intraepidérmica en la piel de pacientes con enfermedades dermatológicas pruriginosas, como xerosis senil y DA, así como en modelos de ratones con piel seca. El mecanismo de control de la densidad nerviosa cutánea se regula por el equilibrio de FAN, como FCN, ARTN y AR, y FRN, como Sema3A, producidos por queratinocitos. Estas moléculas de guía axonal también pueden actuar sobre los queratinocitos, las células inmunes y las células endoteliales vasculares, y pueden participar de forma indirecta en la regulación del prurito.
Metaloproteinasa de matriz (MMP)-2 y MMP-8. El proceso de crecimiento del nervio cutáneo en la piel seca requiere varias MMP para que los conos de crecimiento penetren en las barreras de la matriz extracelular (MEC) tridimensional (Fig. 2). Al usar modelos in vitro de la MEC, se encontró que la MMP-2 localizada en el cono de crecimiento participa en la penetración en la membrana basal. Además, se reportó que la MMP-8 secretada por las fibras nerviosas se involucra en el crecimiento nervioso dentro de la dermis. Los niveles de expresión de MMP-2 y MMP-8 aumentan por los FCN y disminuyen por la Sema3A. La selección y el aumento de expresión de las MMP correspondientes a los componentes de la MEC que rodean las fibras nerviosas en crecimiento son necesarias para una penetración eficiente de las fibras nerviosas, lo que sugiere que la activación coordinada de la neurotrofina y la transmisión de señales de la integrina de la MEC es necesaria para una extensión eficiente y de larga distancia del axón. Como la transmisión de señales de la semaforina de clase 3 inhibe la adhesión mediada por la integrina, la estimulación de la Sema3A de las fibras nerviosas en crecimiento proporciona una vía inversa de transmisión de señal para estos eventos.
Fibras peptidérgicas. La sustancia P (SP) y el péptido relacionado con el gen de la calcitonina (PRGC) son neuropéptidos producidos por los nervios sensoriales en la dermis para comunicarse con diferentes poblaciones de células en las diferentes capas de la piel, que a su vez estimulan las fibras nerviosas. Un aumento en las fibras nerviosas periféricas epidérmicas alargadas consiste en fibras C que contienen SP/PRGC, que por lo general representan fibras nerviosas peptidérgicas epidérmicas, reportadas en el modelo AEA.
El neuropéptido péptido liberador de gastrina (PLG) se caracteriza como un neurotransmisor que transmite de forma específica señales de prurito y se expresa en un pequeño subconjunto de neuronas peptidérgicas del ganglio de la raíz dorsal (GRD). La ablación genética de las neuronas del receptor PLG (RPLG)+ resultó en una reducción significativa en la respuesta al rascado a múltiples pruritógenos. Se demostró que el factor de transcripción Tlx3 en la médula espinal es esencial para el desarrollo de neuronas RPLG+. Huang y colaboradores reportaron que los ratones con la eliminación condicional de Tlx3 (ratones Tlx3F/F; Nav1.8-Cre que perdieron de forma específica la expresión de Tlx3 en la mayoría de las neuronas de linaje TrkA del GRD) se rascaron mucho menos en comparación con los controles en el modelo de piel seca, lo que sugiere un deterioro del prurito crónica inducido por la sequedad de la piel en estos ratones.
Fibras no peptidérgicas. Las fibras C se dividen en subconjuntos peptidérgicos y no peptidérgicos de forma principal de acuerdo con criterios neuroquímicos. Las neuronas peptidérgicas se marcan principalmente por neuropéptidos, como la SP y el PRGC, mientras que las neuronas no peptidérgicas se marcan de manera común por el receptor purinérgico P2X3 y la lectina isolectina B4 (IB4) de las plantas. Al contrario de informes anteriores de participación de la SP y el PRGC en el modelo AEA, un estudio reciente reportó que el tratamiento con AEA aumentó las fibras intraepidérmicas no peptidérgicas, pero no las fibras PRGC+, lo que sugiere que un subconjunto específico de fibras no peptidérgicas funciona en el prurito de la piel seca, como se obervó en el comportamiento de prurito del modelo de ratón con psoriasis inducida por imiquimod.
Receptores activados por proteasas (RAP). Los RAP constan de 4 miembros: RAP-1, RAP-2, RAP-3 y RAP-4. Los RAP a excepción de RAP-3 se expresan en las fibras nerviosas cutáneas, los queratinocitos, las células cebadas y los macrófagos, y se consideran implicados en el prurito. El comportamiento de rascado espontáneo en animales con piel seca tratados se atenuó de forma significativa por un anticuerpo RAP-2 ya sea administrado de forma local al área de piel seca o de forma sistémica. Además, las células del GRD de ratones tratados con AEA exhibieron respuestas mayores de forma significativa al agonista de RAP-2, lo que implica un papel para los agonistas endógenos de este receptor en el prurito crónico.
Familia del receptor acoplado a la proteína G relacionada con Mas (Mrgpr). La familia Mrgpr en ratones se agrupa en varias subfamilias: MrgprA, MrgprB, MrgprC y MrgprD-G. MrgprA3, MrgprC11 y MrgprD en ratones, que se expresan sólo en neuronas sensoriales de diámetro pequeño en el GRD y el ganglio del trigémino (TG), y de manera reciente se sugirió que participan en la transmisión del prurito. Se encontró que la expresión de ARNm que codifica MrgprA3 y MrgprC11 es mayor en ratones del modelo de piel seca tratados con AEA que en controles tratados con agua. Además, la ablación de las neuronas del GRD MrgprA3+ redujo el prurito crónica inducido por el tratamiento con AEA, lo que sugiere que MrgprA3 interviene en el prurito relacionado con la piel seca. Los aumentos en la expresión de MrgprA3 y MrgprC11 se inhibieron en ratones con eliminación de canal iónico con detección de ácido 3 (ASIC3), lo que sugiere que las fluctuaciones en el pH de la piel se involucran en el prurito relacionada con la piel seca.
Familia del receptor potencial transitorio (RPT). Los canales RPT se conocen como sensores celulares polimodales. Se reportó que el miembro 1 de la subfamilia A del canal iónico RPT (RPTA1) mide el prurito agudo independiente de histamina, por ejemplo, la activación de neuronas sensoriales y el comportamiento de prurito posterior a 2 pruritógenos independientes de histamina, cloroquina y BAM8-22. Wilson y colaboradores encontraron que se requiere RPTA1 funcional para los fenotipos evocados por la piel seca, incluido el rascado evocado por AEA, la hiperplasia epidérmica y los cambios de expresión en la piel. Entre los genes de la enfermedad humana, RPTA1 regula los cambios tanto dependientes como independientes del rascado: AQP3, IL-33, el receptor de quimiocina CXCR2, lipocalina, Slc9a3r1 y S100A9 requieren RPTA1, y son independientes del ciclo de rascado y prurito. CCL27 y tenascina C (TNC) dependen del rascado y RPTA1. Estos genes desempeñan diversos roles en el inicio y el mantenimiento del prurito crónico.
El miembro 1 de la subfamilia V del canal catiónico RPT (RPTV1) es un canal catiónico sensible al calor que se expresa de forma selectiva en una población de neuronas sensoriales primarias en el TG y el GRD, que desempeña un papel importante en las sensaciones térmicas y de dolor. Yu y colaboradores reportaron un aumento de la densidad de inervación de las fibras sensoriales que expresan RPTV1 en la piel de los ratones de modelo AEA debido a la expansión de este canal. Esto también se involucra de forma parcial en la inducción y/o mejora del prurito en la piel seca.
Agrupaciones de NP de neuronas sensoriales. Usoskin y colaboradores reportaron 4 grupos neuronales (además divididos en 11 tipos de neuronas sensoriales fundamentales) en células individuales de neuronas sensoriales de GRD lumbares de ratón. El primer grupo es el grupo NF (incluido NF1-5), que expresa la cadena pesada del neurofilamento (Nefh) y la parvalbúmina (Pvalb), y se asoció de forma previa con neuronas mielinizadas del GRD. El segundo, el grupo PEP (incluido PEP1-2), expresó SP (Tac1), TRKA (Ntrk1) y PRGC, que se asociaron de forma previa con nociceptores peptidérgicos. El tercero, el grupo NP (incluido NP1-3), expresó Mrgprd y P2rx3, que se asociaron con noceceptores no peptidérgicos. El cuarto, el grupo TH, exhibió una expresión distinta de tirosina hidroxilasa (Th) y se decribió en una subclase distinta de neuronas no mielinizadas. Además, se notificó que los tipos neuronales NP1, NP2 y NP3 funcionan en el prurito, y es probable que NP3 detecte y transduzca el prurito inflamatorio. Se detectaron neuronas sensibles al ácido lisofosfatídico (Lpar3 y Lpar5) en la clase NP1, neuronas sensibles a la cloroquina (Mrgpra3 y Mrgprx1) en NP2 y neuronas que responden a interleucina (IL)-31 (Il31ra y Osmr) y leucotrieno de cisteína (Cysltr2), péptidos natriuréticos neuropéptidos, neurotensina y marcadores de somatostatina (Nppb, Nts y Sst), y un nivel bajo de P2X3 en NP3. Se encontraron receptores de histamina (Hth1) en NP2 y NP3, y receptores de serotonina (Htr1f, Htr2a) en NP3 y PEP2. Por lo tanto, sus datos respaldan la existencia de al menos 3 clases de neuronas sensibles al prurito con perfiles únicos de respuesta: el ácido lisofosfatídico asociado con trastornos colestáticos se sincroniza con neuronas NP1, la cloroquina y la histamina asociadas con prurito agudo se sintonizan con neuronas NP2, y mediadores, como la IL-31 y los leucotrienos de cisteína, que se vinculan a estados crónicos de prurito inflamatorio, así como a la histamina y la serotonina, quizá comprometen las neuronas NP3. Estos nuevos tipos y clasificación de neuronas se relacionan de forma estrecha con el mecanismo patológico del prurito inducido por la piel seca.
Queratinocitos
Se reportó que el miembro 4 de la subfamilia V del receptor del canal catiónico de potencial transitorio (RPTV4) se involucra en el prurito agudo provocado por la histamina y la 5-hidroxitriptamina (5-HT) aplicadas de forma exógena. Luo y colaboradores revelaron que RPTV4 se expresa de manera selectiva por queratinocitos epdérmicos en ratones. La eliminación específica del linaje del RPTV4 en queratinocitos redujo el prurito en ratones tratados con AEA. Además, el prurito crónico dependiente de RPTV4 requiere la transmisión de señales de 5-HT secundaria a la activación de distintos receptores de 5-HT en AEA como transmisión posterior de señales.
La DA y la dermatitis por contacto alérgica (DCA) son enfermedades cutáneas caracterizadas por piel seca y prurito crónico. Se demostró que, por medio de la activación de PAR-2 en los queratinocitos, la citocina linfopoyetina del estroma tímico (LPET) producida por los queratinocitos desempeña un papel importante en el desarrollo de la DA. Es de destacar que se reportó además que los queratinocitos se comunican de forma directa con las neuronas sensoriales cutáneas por medio de la LPET para promover el prurito. Wilson y coalboradores identificaron la vía de transmisión de señales de calcio ORAI1/NFAT como un regulador esencial de la liberación de la LPET de los queratinocitos, y la LPET actúa de forma directa sobre un subconjunto de neuronas sensoriales positivas para RPTA1 para desencadenar el prurito.
Liu y colaboradores también reportaron que la IL-33 producida y liberada por los queratinocitos es una citocina clave que aumenta su expresión en la piel de los ratones del modelo con DCA con urushiol. En este estudio, la IL-33 y su receptor ST2 (expresado en neuronas del GRD, que inervan la piel) están presentes de manera funcional en las neuronas sensoriales primarias y se encontró que conducen al prurito en este modelo. Los estudios revelaron que el estrés hipoosmótico a los queratinocitos, como el observado en la DA, y los traumatismos en la piel, como el arrancamiento de cinta, promueven la producción de IL-33 a partir de los queratinocitos. Al tener en cuenta la estrecha relación entre la piel seca con prurito y DA o DCA, es muy posible que la LPET y la IL-33 producidas por los queratinocitos desempeñen un papel esencial en el mecanismo de la piel seca.
Médula espinal
Sistema del péptido liberador de gastrina. El PLG y su receptor (RPLG), un receptor acoplado a la proteína Gαq (RAPG), se reportaron como moléculas de transmisión de señales específicas del prurito y se expresaron en la médula espinal. El PLG intratecal actúa por medio del RPLG para inducir un comportamiento de rascado. PI3Kγ, un miembro de las cinasas de lípidos que participan en la cascada de transmisión intracelular de señales, se activa secundario al RAPG y se relaciona con el prurito. En un modelo de prurito en piel seca, el bloqueo del RPLG o la inhibición de PI3Kγ por vía intratecal o sistémica, atenuaron el comportamiento de rascado, lo que sugiere que el RPLG se expresa por los terminales centrales de los aferentes nociceptivos del GRD, que transmiten el prurito por medio de la vía PI3Kγ. Estos datos sugieren que el sistema espinal PLG/RPLG se involucra de manera parcial en la inducción de prurito en la piel seca.
Quimiocinas. Las quimiocinas se expresan en el sistema nervioso central, donde regulan su función en condiciones fisiológicas y patológicas, incluido el desarrollo neuronal, la transmisión sináptica y la neuroinflamación asociada a la enfermedad. Qu y colaboradores reportaron que el ligando 10 de quimiocina con motivo C-X-C (CXCL10) y el receptor 3 de quimiocina con motivo C-X-C (CXCR3) aumentan en el GRD en un modelo de DCA, y CXCL10 activa de forma directa un subconjunto de neuronas cutáneas del GRD por medio de CXCR3 neuronal. Es de destacar que el tratamiento con AEA indujo la expresión de CXCR3 y CXCL10 en la médula espinal, y los ratones CXCR3-/- tuvieron menos respuestas al rascado que los ratones control. Además, la activación de astrocitos inducida por AEA se redujo en ratones CXCR3-/-, lo que sugiere que el CXCR3 espinal desempeña un papel esencial en la patogénesis del prurito crónica inducido por la piel seca.
Receptores tipo Toll (TLR). Los TLR son proteínas transmembrana tipo I que median la inmunidad innata y adaptativa mediante el reconocimiento de ligandos exógenos y endógenos producidos después de una lesión tisular. Cada vez hay más pruebas de que las neuronas sensoriales primarias expresan TLR, por ejemplo, TLR3 y TLR4 y sus funciones importantes, como la activación glial de la médula espinal en el dolor neuropático. El modelo de ratón AEA exhibió un aumento persistente de la expresión del ARNm de TLR4 y una expresión aumentada de TLR4 en astrocitos que expresan GFAP en el asta dorsal espinal. Los ratones TLR4-/- exhibieron reducciones sustanciales en el rascado y la aloknesis, un prurito provocado por el tacto en ratones de tipo salvaje, después de AEA. Este modelo también indujo astrogliosis dependiente de TLR4 (aumento de la expresión de GFAP) en la médula espinal. La inyección intratecal del inhibidor astroglial L-α-aminoadipato redujo el prurito y la aloknesis inducidas por AEA. El rascado desempeña un papel esencial en la astrogliosis espinal debido a que la astrogliosis inducida por AEA se anuló al colocar collares en el cuello para evitar rascarse. La inyección intratecal de lipopolisacárido de Rhodobacter sphaeroides (LPS-RS), un antagonista de TLR4, suprimió el prurito y la aloknesis inducidas por AEA. Estos hallazgos sugieren que la transmisión espinal de señales de TLR4 es importante para la activación de los astrocitos espinales y la astrogliosis, que son la base del prurito crónico y la aloknesis.
Factor de necrosis tumoral α (TNF-α). La evidencia emergente sugiere que las citocinas y las quimiocinas también sirven como mediadores y/o moduladores clave del prurito. Se reportó que TNF-α desempeña un papel central en la regulación de la plasticidad sináptica en la médula espinal y el dolor crónico por medio de sus receptores, TNFR1 y/o TNFR2. El prurito en la piel seca inducida por AEA se redujo mediante la administración de talidomida (inhibidor de la síntesis de TNF-α) y etanercept (antagonista de TNF-α), y en ratones con doble desactivación TNFR1/R2. El tratamiento con AEA indujo la expresión de TNF-α en la piel, el GRD y la médula espinal, y la expresión de TNFR1 sólo en la médula espinal. Por lo tanto, estos hallazgos sugieren que la transmisión de señales de TNF-α/TNFR1 es en parte necesaria para la expresión completa de prurito crónico en la piel seca por medio de mecanismos periféricos y centrales.
Otros
Proteína cinasa 70 asociada a la cadena zeta. Se reportó que la vía de transmisión de señales de las células T participa en el prurito de la piel seca. La proteína cinasa 70 asociada a la cadena zeta (ZAP70) como un receptor de las células T, induce la secreción de IL-2 y promueve la secreción de FCN en la piel. Después del tratamiento con AEA, los ratones AEA de 22 meses exhibieron un mayor rascado espontáneo en comparación con los ratones AEA de 5 meses. La expresión de ZAP70 aumentó de manera significativa, además de la secreción de IL-2 y FCN en ratones AEA de 22 meses en comparación con ratones AEA de 5 meses. Este estudio reveló que el aumento de ZAP70 se involucra en la piel seca en el prurito en personas de edad avanzada, debido a una mayor secreción de IL-2 y FCN.
Receptor tipo Toll 3. Se descubrió que TLR3 es un receptor importante en la transmisión de señales del prurito múrido, y se expresa por nervios sensoriales y GRD en ratones. TLR3 también se expresa por células cebadas y queratinocitos. El tratamiento con AEA provocó un aumento marcado de 25 veces en la expresión de TLR3 en la piel, pero no en los GRD. Además, el tratamiento con AEA indujo un aumento marcado de la expresión de FCN en la piel, que dependía de TLR3. El prurito espontáneo se eliminó en ratones TLR3-/-. Por lo tanto, TLR3 y su aumento de expresión en la piel seca son importantes para la inducción y la sensibilización del prurito crónico.
Opioides. Estudios anteriores identificaron 4 tipos principales de receptores de opioides, tipo μ (MOR, un receptor para las endorfinas β), tipo κ (KOR, un receptor para dinorfinas), tipo δ (un receptor para encefalinas) y nocicepción (un receptor para la nociceptina/orfanina FQ). Se cree que la activación de los receptores opioides μ induce prurito, mientras que la activación de los receptores opioides κ tiene efectos supresores. Se reportó que el sistema opioide κ disminuye su expresión en la epidermis de pacientes con DA, y que la terapia con psoraleno ultravioleta A (PUVA) aumenta la expresión del sistema opioide μ y restaura el sistema opioide κ, concomitante con una disminución en el puntaje de la escala visual análoga (EVA). El rascado espontáneo después del tratamiento con AEA se suprimió de manera significativa mediante la inyección subcutánea de antagonistas de opioides μ, como la naloxona y la naltrexona, y el agonista de opioides κ nalfurafina, por medio de mecanismos periféricos y centrales.
Hiperknesis
El término “hiperknesis” se propuso como un término general que abarca el estado en el que hay prurito más intenso a estímulos que provocan prurito normal o umbral reducido de prurito a un estímulo dado. Los mecanismos de la hiperknesis no están claros, y se desconoce qué tipo de aferentes median el prurito leve que resulta de los estímulos punzantes. La hiperknesis está mediada por fibras Aδ tipo I por medio de un mecanismo central cuando es secundaria a la provocación de prurito o una lesión cutánea con prurito activo.
Akiyama y colaboradores reportaron un aumento significativo en el número de ataques de rascado provocados por inyecciones intradérmicas de un agonista de PAR-2 y 5-HT en condiciones de piel seca. Además, las células del GRD de ratones tratados con AEA exhibieron respuestas mayores de manera significativa al agonista de PAR 2 y 5-HT. Además, se reportaron respuestas mejoradas de las neuronas dorsales superficiales lumbares al agonista intradérmico PAR-2 en este modelo. Esto implica que el prurito agudo provocado por ciertos prurigénicos, como los agonistas 5-HT y PAR-2, aumenta en el prurito crónico de la piel. Esto refleja la hiperknesis, que es consistente con la sensibilización de las vías de transmisión de señales del prurito.
Aloknesis
Se reportó que los estímulos mecánicos inocuos provocan prurito cuando se administran dentro de una región de piel normal que rodea un sitio de prurito experimental inducido por la inyección intradérmica de histamina, un fenómeno conocido como prurito en la piel o aloknesis. La aloknesis refleja un mecanismo central en el que la activación de los mecanorreceptores de umbral bajo excita las neuronas sensibilizadas del prurito en la médula espinal. La estimulación mecánica inocua provocó rascarse cuando se administró en el borde de una región de tratamiento con AEA en ratones, lo que sugiere la presencia de aloknesis en este modelo animal de prurito crónico en la piel seca.
Las células de Merkel, los receptores táctiles en la piel, se reportaron para hacer contactos “tipo sinapsis” con aferentes tipo I que se adaptan de forma lenta. Feng y colaboradores reportaron que la aloknesis en piel seca se asocia con una pérdida de células de Merkel. La eliminación genética dirigida de las células de Merkel y sus canales asociados Piezo2 mecanosensibles produjeron aloknesis. La activación quimiogenética de las células de Merkel protegió contra la aloknesis en la piel seca. Estos datos sugieren que la transmisión cutánea de señales del canal Piezo2 de células de Merkel es crítica en la modulación de la conversión del tacto al prurito.
PRURITO DE LA PIEL SECA Y ANSIEDAD
El prurito crónico se relaciona de forma clínica con el desarrollo de trastornos del estado de ánimo, como ansiedad y depresión, de manera predominante en pacientes dermatológicos. La carga psicológica producida por el prurito crónico se reportó con incidencias altas de ideación suicida (21.1%) y enfermedades psiquiátricas (70%). Zhao y colaboradores reportaron que los ratones AEA desarrollaron síntomas similares a la ansiedad 2-3 semanas y fenotipos similares a la depresión 3-4 semanas después del tratamiento con AEA, lo que sugiere que el deterioro del estado de ánimo debido al prurito crónico evoluciona con el tiempo. Los comportamientos de deterioro del estado de ánimo se relacionaron de manera significativa con el comportamiento asociado con el prurito. También demostraron una alteración primaria de la función del eje hipotalámico pituitario suprarrenal (HPA) en ratones tratados con AEA con prurito crónico.
La amígdala es la región cerebral clave para la generación de ansiedad. De manera reciente, Sanders y colaboradores reportaron que los estímulos de prurito agudo, como la histamina, indujeron un comportamiento similar a la ansiedad y aumentaron la actividad neuronal en una subpoblación de la amígdala en ratones adultos. Estos resultados destacan la importancia de las neuronas de la amígdala sensibles al prurito en la regulación de los efectos y el comportamiento relacionados con el prurito, que también se aplican a las condiciones crónicas de prurito debido a la piel seca.
MANEJO DEL PRURITO INDUCIDO POR LA PIEL SECA
Desde que se reportaron los mecanismos del prurito inducido por la piel seca en modelos animales, se realizaron muchos estudios sobre el tratamiento del prurito inducido por la piel seca (Fig. 2 y Tabla I).
Antihistamínicos
Se reportó que los antihistamínicos H1 de segunda generación (por ejemplo, bepotastina) fueron beneficiosos para el prurito en pacientes con DA. De manera reciente, se demostró que la bepotastina disminuyó el ARNm de los FAN (FCN y ARTN) en los queratinocitos epidérmicos humanos normales. La alteración se medió por la actividad de transcripción de mecanismos dependientes de AP-1 y/o NF-kB por medio del receptor de histamina H1. Estos resultados proporcionan evidencia terapéutica de que los antihistamínicos H1 de segunda generación son efectivos para controlar el prurito asociado con la densidad del nervio epidérmico en condiciones de piel seca. Otro informe encontró que la aplicación tópica de antihistamínicos H1 (difenhidramina) y H2 (famotidina) previno la hiperplasia epidérmica en ratones cuya barrera cutánea se interrumpió por el tratamiento con acetona. Similar a muchas afecciones pruríticas intratables, se cree que el prurito inducido por AEA es independiente de la histamina; sin embargo, los antihistamínicos pueden mejorar en parte la función de barrera de la piel y la hiperinervación epidérmica en condiciones de piel seca.
Emolientes
En un estudio anterior, la aplicación inmediata y tardía de emolientes, por ejemplo, vaselina hidrofílica y crema heparinoide, sobre la piel seca inducida por acetona redujo el número de fibras nerviosas intraepidérmicas penetradas y los niveles de FCN en la piel del ratón. Además, la aplicación de loción humectante tipo gel (TSG), que contenía agua, glicerina, urea, metil parabeno, propil parabeno y agar, redujo el número de fibras nerviosas intraepidérmicas infiltradas e indujo una mayor expresión de Sema3A en la epidermis de ratones tratados con AEA. Esto sugiere que la aplicación tópica de TSG atenúa el prurito inducido por la piel seca crónica por medio de un mecanismo que implica la inhibición de la hiperinervación epidérmica.
Fototerapia
Las terapias basadas en rayos UV, como PUVA y ultravioleta B de banda estrecha (NB-UVB), son eficaces en el tratamiento del prurito crónico en pacientes con DA y psoriasis. En un estudio anterior, la terapia PUVA redujo la hiperinervación epidérmica en pacientes con DA. Además, en el modelo de ratones de piel seca inducida por acetona, el ungüento de PUVA, PUVA + valerato de betametasona (BV), NB-UVB y los tratamientos con lámpara de excímeros redujeron de forma significativa el crecimiento del nervio intraepidérmico inducido en este modelo. PUVA + BV y NB-UVB también normalizaron la expresión anormal de FCN y Sema3A en la epidermis.
Además, se reportó que la irradiación con lámpara de excímeros de las fibras nerviosas formadas por neuronas cultivadas del GRD indujo cambios degenerativos en estas fibras. Se demostró que unir un filtro de excímero de corte (FEC) a la lámpara, lo que disminuye las longitudes de onda citotóxicas, reduce la hiperinervación y la producción de dímero de pirimidina ciclobutano, un marcador de daño en el ADN, en el modelo de ratón de piel seca inducida por acetona. Esto sugiere que los efectos antipruríticos de la irradiación de la lámpara de excímeros con FEC se deben a la inducción de la degeneración del nervio epidérmico y la reducción del daño en el ADN.
Opioides
El prurito relacionada con la piel seca en modelos animales se suprimió por antagonistas del receptor opioide μ y agonistas del receptor opioide κ. De manera clínica, se descubrió que los antagonistas del receptor opioide μ y los agonistas del receptor opioide κ inhiben el prurito en las enfermedades cutáneas o sistémicas relacionadas con la piel seca.
La nalbufina es un analgésico opioide sintético, una mezcla de receptores κ-opioides agonistas-antagonistas de receptores opioides μ, indicados para el dolor moderado a intenso. Una revisión sistemática sugirió que la nalbufina es una opción de tratamiento superior para el prurito inducido por opioides debido a sus efectos antagonistas y su afinidad alta por los receptores opioides μ.
Neurotropina
La neurotropina, un extracto no proteico aislado de la piel inflamada de conejos inoculados con el virus vaccinia, se reportó como un tratamiento efectivo para el prurito resistente a los antihistamínicos en un estudio multicéntrico, abierto, de muestra pequeña. Se decubrió que la neurotropina inhibe in vitro el crecimiento neuronal inducidas por FCN de las neuronas del GRD. Además, la densidad del nervio intraepidérmico en ratones tratados con acetona se redujo mediante la administración intraperitoneal de neurotropina, de manera probable por medio de la expresión de Sema3A en la epidermis.
Fosfolípidos
El ácido eicosapentaenoico (EPA, 20: 5n-3) y el ácido docosahexanoico (DHA, 22: 6n-3) son ácidos grasos poliinsaturados (PUFA) omega 3 (n-3) representativos. Estudios anteriores sugirieron que los PUFA n-3 y los metabolitos monohidroxilados relacionados desempeñan un papel esencial en la homoeostasis de la piel ya que su contenido dentro de la piel regula la función de la barrera cutánea. La suplementación de aceite de pescado, una fuente conocida de PUFA n-3, en un modelo de ratón de piel seca inducida por acetona restableció los defectos de la barrera cutánea y mejoró el comportamiento de rascado.
Se informó que los fosfolípidos derivados de la leche (FLL) y la esfingomielina derivada de la leche tienen efectos beneficiosos sobre las funciones epidérmicas, como un aumento de la hidratación del EC en ratones HR-1 normales sin pelo y una función mejorada de la barrera cutánea en el modelo de ratón HR-DA. De manera reciente, se reportó que los FLL en la dieta atenúan la penetración de las fibras nerviosas en la epidermis al reducir los niveles epidérmicos de FCN y aumentar el nivel de Sema3A en un modelo de ratón de piel seca inducida por acetona. Por lo tanto, los FLL en la dieta tiene efectos beneficiosos para la prevención y/o el alivio del prurito inducido por la piel seca al reducir la densidad de la fibra nerviosa intraepidérmica.
Tripéptido de colágeno
El tripéptido de colágeno es una fracción purificada de colágeno, no antigénica y poco alergénica que se sabe que tiene muchos efectos biológicos, como el aumento de la producción de ácido hialurónico en fibroblastos dérmicos humanos in vitro y en piel múrida in vivo. La administración oral de tripéptido de colágeno a ratones de modelos de piel seca inducida por acetona mejoró la piel seca y normalizó los factores de guía del axón en la epidermis, además redujo el prurito.
Antioxidantes
Se propuso durante mucho tiempo que el estrés oxidativo desempeña un papel en la patogénesis de las enfermedades cutáneas y sistémicas relacionadas con el prurito, como la DA, la psoriasis y la insuficiencia renal crónica. Se demostró que los oxidantes inducen prurito independiente de histamina mediante la activación de RPTA1 en ratones. Zhou y colaboradores reportaron que los antioxidantes eran efectivos de manera sistemática para reducir los ataques de rascado de los ratones tratados con AEA, mediante la inhibición del estrés oxidativo en la periferia (piel afectada) y la supresión de la activación de p-ERK en la médula espinal. Por lo tanto, los antioxidantes, como la N-acetil-L-cisteína y la N-terc-butil-a-fenilnitrona, tienen efectos terapéuticos sobre el prurito inducido por la piel seca.
Apósitos de película
De manera más reciente, se reportó que la aplicación de apósitos de película, que se utilizan para el tratamiento de heridas para proporcionar un ambiente húmedo adecuado y que actúan como una barrera contra la contaminación, alivia la hiperinervación epidérmica y la aloknesis en los ratones del modelo de piel seca inducido por AEA. Los apósitos de película reducen la hipersensibilidad del prurito de la piel. De acuerdo con esto, se descubrió que el nivel de FCN en la epidermis del ratón disminuyó de manera significativa por la oclusión con emolientes o una membrana impermeable al vapor después de la interrupción de la barrera cutánea por arrancamiento de cinta o acetona. Esto sugiere que la hidratación de la piel previene la hiperinervación epidérmica inducida por la interrupción de la barrera y los estímulos mecánicos en la piel.
CONCLUSIÓN
Esta revisión presentó conocimientos recientes sobre los mecanismos de prurito inducido por la piel seca y su manejo. Se cree que una disminución en la función de la barrera cutánea es la causa principal del prurito inducido por la piel seca, como se observa en el modelo AEA, el modelo de piel seca más conocido en ratones. Muchos tipos de mediadores, receptores y canales se involucran en la transmisión de señales del prurito entre el sistema nervioso de la piel, las células de la piel y el sistema nervioso central, incluidos los canales Mrgprs, TLR, citocinas y RPT. Se requieren estudios continuos para comprender mejor estas interacciones complejas y desarrollar fármacos antipruríticos para mejorar la calidad de vida de los pacientes.
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Med. María del Carmen Zárate Hernández Profesor
Dra. Laura Paola Escamilla Luna Residente 1er Año
Dra. Alejandra Macías Weinmann Profesor




No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.