
Ensayo de fase 3 de inmunoterapia epicutánea en niños niños con alergia al maní
Antecedentes
No existe un tratamiento aprobado para la alergia al maní para niños menores de 4 años, y se desconoce la eficacia y seguridad de la inmunoterapia epicutánea con un parche de maní en niños pequeños con alergia al maní.
Métodos
Realizamos este ensayo de fase 3, multicéntrico, doble ciego, aleatorizado y controlado con placebo en el que participaron niños de 1 a 3 años de edad con alergia al maní confirmada mediante una prueba de provocación alimentaria doble ciego controlada con placebo.
Los pacientes que tenían una dosis desencadenante (la dosis necesaria para provocar una reacción alérgica) de 300 mg o menos de proteína de maní fueron asignados en una proporción de 2:1 para recibir inmunoterapia epicutánea administrada por medio de un parche de maní (grupo de intervención) o para recibir placebo administrado diariamente durante 12 meses.
El punto final primario fue una respuesta al tratamiento medida por la dosis desencadenante de proteína de maní a los 12 meses. La seguridad se evaluó de acuerdo con la ocurrencia de eventos adversos durante el uso del parche de maní o el placebo.
Resultados
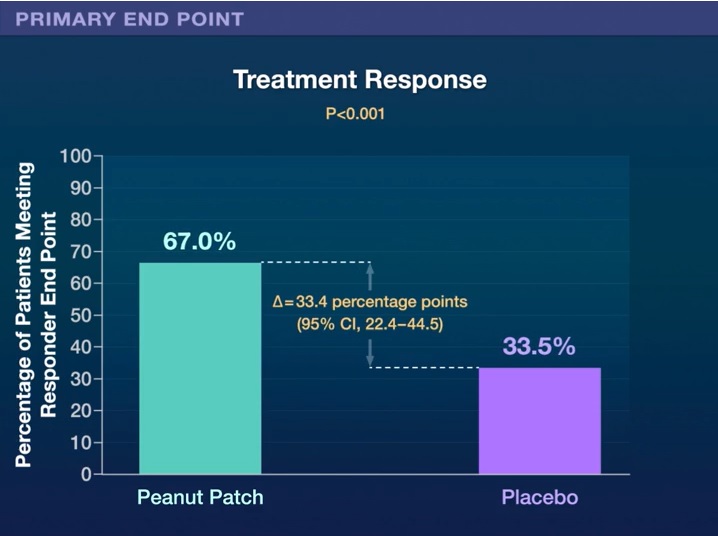
De los 362 pacientes que se aleatorizaron, el 84,8 % completó el ensayo. El resultado de la variable principal de eficacia se observó en el 67,0 % de los niños del grupo de intervención en comparación con el 33,5 % de los del grupo de placebo (diferencia de riesgos, 33,4 puntos porcentuales; intervalo de confianza del 95 %, 22,4 a 44,5; P<0,001).
Los eventos adversos que ocurrieron durante el uso de la intervención o el placebo, independientemente de la relación, se observaron en el 100 % de los pacientes en el grupo de intervención y en el 99,2 % en el grupo de placebo.
Se produjeron eventos adversos graves en el 8,6 % de los pacientes del grupo de intervención y en el 2,5 % de los del grupo de placebo; la anafilaxia ocurrió en 7,8% y 3,4%, respectivamente. Se produjeron eventos adversos graves relacionados con el tratamiento en el 0,4 % de los pacientes del grupo de intervención y en ninguno del grupo de placebo.
Conclusiones En este ensayo en el que participaron niños de 1 a 3 años con alergia al maní, la inmunoterapia epicutánea durante 12 meses fue superior al placebo para desensibilizar a los niños al maní y aumentar la dosis de maní que desencadenó los síntomas alérgicos. |
Comentarios
Un ensayo clínico global de fase 3 encontró que una inmunoterapia de un año a través de un parche cutáneo desensibilizaba de forma segura a los niños pequeños con alergia al maní, lo que reducía el riesgo de una reacción alérgica grave por exposición accidental.
Un ensayo clínico global de fase 3 que incluyó al Ann & Robert H. Lurie Children's Hospital of Chicago encontró que una inmunoterapia de un año a través de un parche cutáneo desensibiliza de manera segura a los niños pequeños con alergia al maní, lo que reduce el riesgo de una reacción alérgica grave por exposición accidental. Los resultados de este ensayo aleatorizado, doble ciego y controlado con placebo para niños de 1 a 3 años de edad, financiado por DBV Technologies, se publicaron en el New England Journal of Medicine.
"Nos entusiasmó contribuir a este estudio histórico que es tan prometedor para nuestros pacientes jóvenes con alergia al maní", dijo la coautora Melanie Makhija, MD, quien fue la investigadora principal del estudio en Lurie Children's y es profesora asociada de Pediatría en la Facultad de Medicina Feinberg de la Universidad Northwestern. "Los niños que originalmente reaccionaron a una pequeña fracción de maní pudieron tolerar el equivalente de uno a cuatro maní después de completar el ciclo de tratamiento. Esto significa que estos niños estarán bien protegidos de la exposición accidental al maní. Es importante destacar que descubrimos que la el parche de maní era seguro, con muy pocas posibilidades de una reacción alérgica grave. Esta es una excelente noticia para las familias de niños con alergias al maní".
La alergia al maní afecta aproximadamente al 2 por ciento de los niños en los Estados Unidos, Canadá y otros países occidentalizados, y comúnmente persiste hasta la edad adulta. Las reacciones alérgicas potencialmente mortales pueden desencadenarse por la exposición no intencional a cantidades mínimas, incluso a través de productos fabricados en equipos compartidos como los cacahuetes. Actualmente, no hay tratamientos aprobados para niños menores de 4 años alérgicos al maní.
Desde 2012, el programa de ensayos clínicos para alergias alimentarias de Lurie Children's ha inscrito a pacientes en numerosos estudios de tratamientos novedosos, incluida la inmunoterapia oral para maní que ha sido aprobada por la Administración de Alimentos y Medicamentos (FDA). Los ensayos en curso están disponibles para todos los grupos de edad, desde la infancia hasta la edad adulta. El programa está dirigido por los investigadores principales Elizabeth Lippner, MD, y Abigail Lang, MD, MSCI.
La investigación en el Ann & Robert H. Lurie Children's Hospital of Chicago se lleva a cabo a través del Stanley Manne Children's Research Institute. El Instituto de Investigación Manne se centra en mejorar la salud infantil, transformar la medicina pediátrica y garantizar un futuro más saludable a través de la búsqueda incesante del conocimiento. Lurie Children's es una organización sin fines de lucro comprometida con brindar acceso a una atención excepcional para todos los niños. Está clasificado como uno de los mejores hospitales pediátricos del país por U.S. News & World Report. Lurie Children's es el centro de capacitación pediátrica de la Facultad de Medicina Feinberg de la Universidad Northwestern.
Referencia: Phase 3 Trial of Epicutaneous Immunotherapy in Toddlers with Peanut Allergy. New England Journal of Medicine, 2023; 388 (19): 1755 DOI: 10.1056/NEJMoa2212895 Matthew Greenhawt, M.D., Sayantani B. Sindher, M.D., Julie Wang, M.D., Michael O’Sullivan, et al.
Fuente: https://www.intramed.net/
No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.