| Introducción |
La eritromelalgia (EM) es una enfermedad debilitante rara caracterizada por episodios de dolor ardiente asociado con pies rojos y calientes y ocasionalmente las manos.
Durante los síntomas, los pies y las manos pueden estar hinchados aunque el edema no está universalmente presente o reportado.
El control endógeno de la temperatura, probablemente a través de la vasodilatación de las anastomosis arteriovenosas termorreguladoras, puede ser un factor clave en el mecanismo fisiopatológico de la eritromelalgia (EM). A menudo, se desencadenan episodios a partir de la actividad física y la exposición a temperaturas cálidas mientras que el dolor se alivia en forma característica por el enfriamiento de las zonas afectadas.
Debido a que los síntomas son intermitentesy los pies y las manos pueden parecer normales en la consulta, el diagnóstico puede ser omitido. Los pacientes suelen solicitar la atención médica de diversas especialidades, como atención primaria, dermatología, medicina vascular, neurología y medicina del dolor. Los pacientes tienen menor calidad de vida, aumento de la morbilidad y la mortalidad así como mayor riesgo de suicidio en comparación con la población general de EE. UU.
El tratamiento efectivo para el alivio de los síntomas es fundamental para evitar las complicaciones graves y mejorar los resultados. Para denominar la afección existen términos como EM primaria y EM secundaria pero su uso es variado y pueden dar lugar a confusión.
Convencionalmente, la denominación eritromelalgia secundaria se utiliza para la EM que tiene una causa subyacente identificable. El término EM primaria se utiliza para la EM sin una causa subyacente identificable (EM idiopática). También se ha utilizado el término EM primaria como sinónimo de EM heredada, para describir la EM en pacientes con antecedentes familiares de la enfermedad. Sin embargo, etiquetar la EM como primaria o secundaria no afecta mucho su manejo.
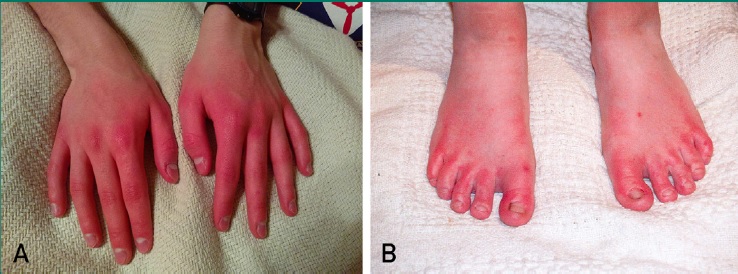
Manos y pies durante un episodio de eritromelalgia. Las manos (A) y los pies (B) pueden estar rojos, dolorosos y calientes.
| Eritomelalgia primaria (heredadao) |
Aproximadamente el 5% de los pacientes tienen antecedentes familiares de EM, y muchos tienen una herencia autosómica dominante.
En estudios de familias con EM autosómica dominante se ha descrito una variante en la secuencia del gen SCN9A, caracterizado por codificar la subunidad Nav1.7 de los canales neuronales de sodio, localizados preferentemente en los ganglios simpáticos y neuronas sensoriales nociceptivas de los ganglios de la raíz dorsal.
La variante secuencial, una variante de ganancia de función, hace que los canales de sodio neuronales Nav1.7 se abran más fácilmente y permanzcan abiertos, lo que da lugar a una activación múltiple y prolongada en estas neuronas sensoriales. Esto ayuda a explicar el dolor desproporcionado que experimentan los pacientes durante los episodios de EM. S ha informado que esta variante de ganancia de función de Nav1.7 produce hipoexcitabilidad de las neuronas del sistema simpático.
La historia natural de la EM primaria ha sido bien caracterizada a partir de una serie relativamente grande de 13 pacientes con EM primaria y variantes de secuencia de SCN9A. Casi un tercio de los ataques de dolor no tuvieron un desencadenante identificable, y la mayoría de los pacientes tenían dolor entre los ataques.
Se ha considerado que la EM es la primera neuropatía dolorosa hereditaria conocida a nivel molecular y como modelo de enfermedad, lo que podría ser aleccionador para otras condiciones dolorosas. Sin embargo, la EM familiar no siempre está relacionada con el SCN9A. Por ejemplo, un familiar de tercera generación con EM primaria no se ha detectado variantes de SCN9A, lo que sugiere que también otro gen podría estar relacionado con este trastorno.
| Eritromelalgia secundaria |
Se han descrito muchas asociaciones de EM con trastornos subyacentes, pero no está muy claro si la EM es verdaderamente secundaria a estos trastornos. Aproximadamente el 5% de los pacientes con EM tienen una enfermedad mieloproliferativa (por. ej., trombocitemia esencial y policitemia rubra vera).
En estos pacientes, el manejo de los aspectos microvasculares de la EM pueden ser importantes, dado que la EM asociada con una enfermedad mieloproliferativa es más propensa a responder a la aspirina.
Se han descrito asociaciones con enfermedades autoinmunes subyacentes y otros trastornos así como la relación con medicamentos, pero son mucho menos constantes.
| Asociación con neuropatía |
Hay evidencia de la estrecha asociación entre la EM y la neuropatía de fibras pequeñas y grandes.
Casi el 50% de los pacientes con EM muestran una neuropatía de fibras grandes en el electromiograma y los estudios de conducción nerviosa.
La presencia de neuropatía de fibras pequeñas se determina mediante la evaluación funcional de las fibras pequeñas mediante pruebas de sudoración, incluyendo la prueba de termorregulación del sudor y la prueba cuantitativa del reflejo axónico sudomotor.
La prueba de termorregulación del sudor muestra anomalías marcadas en aproximadamente el 90% de los pacientes. esta prueba es una excelente medida de la neuropatía sensitiva de fibras pequeñas en la piel, ya que las glándulas sudoríparas están mediada por fibras nerviosas pequeñas. Las pruebas de fibras pequeñas también han informado la alteración de la función de las fibras pequeñas en pacientes con EM.
Se destaca que los hallazgos en la biopsia de piel (a menudo utilizada para diagnosticar neuropatía de fibras pequeñas) son típicamente inespecíficos y muestran una disminución de la densidad de fibras nerviosas epidérmicas en solo una minoría de casos. Si la neuropatía conduce a la EM o viceversa no está claro. las neuropatías de fibras pequeñas podrían precipitar la EM. Por el contrario, una enfermedad subyacente, incluida la hiperexcitabilidad Nav1.7 y el tratamiento de agua fría también pueden conducir a la neuropatía de fibras pequeñas.
| Estrategias para el manejo no farmacológico |
Los síntomas de dolor ardiente asociados a episodios de enrojecimiento de las extremidades pueden dominar la vida de los pacientes ya que tratan de evitar situaciones que exacerben su dolor, y la EM puede progresar a un síndrome de dolor crónico debilitante.
Para ayudar a los pacientes a evitar esta progresión, se les recomienda no abandonar su estilo de vida habitual buscando evitar o minimizar tanto como sea posible los disparadores conocidos. Para ello, deben recibir asesoramiento acerca de las recomendaciones del estilo de vida, para minimizar los episodios de EM y síntomas asociados. Estas estrategias son especialmente valiosas porque pueden disminuir la necesidad de tratamientos farmacológicos e intervencionistas.
Los pacientes deben aprender a controlar el dolor con medicamentos tópicos y sistémicos; a abordar los problemas psicológicos asociados, como la ansiedad, y seguir ejerciendo y participando en las actividades diarias normales. Todas son técnicas importantes que ayudan a que los pacientes se adapten a la vida con E.M. No hay evidencia de que la precipitación de los episodios de EM, como el ejercicio, empeoren el resultado a largo plazo de la enfermedad.
Para aliviar el dolor de la EM, los pacientes a menudo tratan de enfriar las extremidades enrojecidas y calientes con hielo o agua fría y utilizan continuamente ventiladores potentes cerca de las extremidades, pero estas acciones pueden aumentar el riesgo de daño tisular, ulceraciones, y discapacidad.
El agua y el hielo pueden conducir al pie de inmersión o pie de trinchera, con hinchazón y ulceración de la piel. También el viento puede provocar lesiones similares a las d las quemaduras, con exacerbación del rubor cuando los ventiladores están detenidos. Por lo tanto, las medidas de enfriamiento para aliviar los síntomas deben ser seguras.
Se debe evitar o limitar el uso de hielo o inmersión en agua (por. ej., 10 minutos y 4 veces/día), y los pacientes debe buscar formas alternativas de refrescarse las extremidades. Algunos pacientes encuentran alivio elevando las extremidades durante los síntomas. A los pacientes que tienen episodios de EM con el ejercicio, como correr, se les puede animar a probar con la natación.
| Tratamientos farmacológicos |
La EM es una condición difícil de tratar. Se pueden utilizar tratamientos tópicos y sistémicos. El resultado de los tratamientos es muy variable. Muchos informes de tratamientos fueron descritos hace varios años (esta revisión bibliográfica abarca los años 1985-2021); hay pocos datos publicados que discutan la durabilidad de los tratamientos reportados.
Como tratamiento de primera línea se pueden usar medicamentos tópicos para alivio del eritema y el dolor, y quizás sea todo lo que se necesita para manejar esta condición. Para pacientes con EM secundaria por enfermedad mieloproliferativa, el tratamiento debe centrarse en abordar la causa subyacente.
La aspirina es el tratamiento sistémico de primera línea para pacientes con EM, particularmente aquellos que tienen enfermedades mieloproliferativas subyacentes. Entonces pueden considerarse otros medicamentos sistémicos.
La aplicación de un enfoque de equipo multidisciplinario es beneficioso para el cuidado de los pacientes con EM. Para pacientes que tienen EM severa, refractaria o con discapacidad, es necesaria la derivación a un centro de rehabilitación completa del dolor.
| Tratamientos tópicos |
Los tratamientos tópicos se consideran una terapia farmacológica de primera línea para la EM. Pueden ser eficaces para suprimir el dolor o el enrojecimiento (o ambos), con disminución de la necesidad de medicamentos sistémicos, con menos efectos adversos en comparación con los medicamentos sistémicos.
Muchos tratamientos tópicos se han utilizado para la EM, con varios niveles de eficacia. Algunos tratamientos pueden usarse para abordar principalmente el dolor asociado con la EM, mientras que otros pueden disminuir el enrojecimiento con la consiguiente disminución del dolor. Para evaluar la eficacia del medicamento tópico, debe ser utilizado durante al menos 4 semanas antes de cambiarlo por otro tratamiento.
> Terapia tópica para el dolor. Se han utilizado varios medicamentos tópicos: lidocaína, amitriptilina combinada con ketamina, y capsaicina.
> Lidocaína. Es una amida de anestésico local que bloquea los canales de sodio requeridos para la iniciación y conducción del impulso neuronal, lo que resulta en anestesia local después de la aplicación tópica. Se puede aplicar como crema, ungüento o parche en las áreas afectadas (pies, manos y otras áreas). Los parches de lidocaína son particularmente prácticos para ser aplicados en las superficies dorsal o plantar del pie, donde se pueden usar hasta 3 parches durante 12-24 horas. Los parches pueden ser más efectivos que la crema o la pomada porque la lidocaína es administrada gradualmente durante horas. En una serie de 34 pacientes con EM que se presentaron a un centro terciario, la mayoría que utilizó los parches de lidocaína al 5% observó una mejoría del dolor, en contraste con 10 pacientes que no respondieron al gel de lidocaína. En esa serie se observó que todos los pacientes habían intentado varios tratamientos antes del parche de lidocaína y que en general, los pacientes con enfermedad de mayor gravedad y duración tendieron a tener una respuesta menor que al parche de lidocaína. No se notó la absorción sistémica de lidocaína ni síntomas de toxicidad por lidocaína.
> Amitriptilina combinada con ketamina. Descrita por primera vez para ser usada en la EM en 2006, esta combinación tópica en un vehículo, aplicada en las áreas afectadas hasta 3 veces/día, fue útil para controlar el dolor de la EM. La amitriptilina, un antidepresivo tricíclico de primera generación, inhibe la recaptación de serotonina y norepinefrina, y bloquea los canales de sodio requeridos para la iniciación y conducción del impulso neuronal.
La ketamina es un antagonista del receptor de N-metil-D-aspartato en terminales periféricas de aferentes nociceptivos primarios; por lo tanto, también bloquea los impulsos neuronales y puede ser eficaz en los ganglios de la raíz dorsal y el asta dorsal. En una serie de casos de 36 pacientes con EM, el 75% notó una mejoría del dolor con amitriptilina tópica al 1-2% compuesta con 0,5% de ketamina. Si esta mezcla compuesta no es eficaz, se puede aumentar la concentración de ketamina, según sea necesario, hasta un 5%. Esta combinación necesita prepararse como receta magistral. En 2020, la FDA de EE. UU. otorgó la designación de medicamento huérfano a un gel de amitriptilina tópica (ATX01; AlgoTx) como tratamiento de la EM.
> Capsaicina. La capsaicina puede ayudar a controlar el dolor cutáneo a través de la desensibilización del receptor TRPV1, lo que provoca una disminución de la liberación de neurotransmisores como la sustancia P, un mediador químico importante en la transmisión de los impulsos de dolor. Hay poca evidencia que apoye la eficacia de la capsaicina tópica en el tratamiento de la EM. Un caso informado señaló que los síntomas de EM mejoraron con la aplicación tópica, 2 veces/día de crema de capsaicina al 0,025%. Dos encuestas señalaron que la capsaicina no fue útil en la mayoría de los pacientes. Según la propia experiencia de los autores de esta revisión, la capsaicina no suele ser útil para los pacientes con E.M. La crema o loción tópica de capsaicina (0,025% a 0,075%) se puede aplicar en áreas afectadas, 3-4 veces/día durante 6 semanas, y se debe advertir a los pacientes que la medicación puede causar escozor inicial y sensaciones de ardor. Los parches de capsaicina tópica (0,025%) se pueden usar fuera de etiqueta en áreas afectadas, ya que se utilizan para el dolor neuropático asociado con neuropatía periférica diabética de los pies; hasta 4 tópicos en uns sola aplicación de 30 minutos, que puede ser repetida cada 3 meses según sea necesario pero no con más frecuencia. Teóricamente, se pueden usar parches de capsaicina con una dosis mayor (8%), ahora para uso clínico, para el tratamiento del dolor crónico; puede ser útil para el manejo de la EM pero no ha estado bien descrito su uso en este trastorno.
> Otros tratamientos tópicos. Las estrategias solo tienen evidencia anecdótica para apoyar su uso. Por ejemplo, de vez en cuando se puede usar una mezcla que contenga hasta 5 ingredientes, añadiendo al compuesto de amitriptilina-ketamina las formulaciones tópicas de ≥1 de los siguientes: clonidina, gabapentina y lidocaína. Como anécdota, los parches de clonidina transdérmicos (0,1 a 0,3 mg/día) han sido útiles para disminuir el dolor de la EM en algunos pacientes de los autores. Ofrecen la ventaja de aplicaciones semanales y, a diferencia de los parches de lidocaína, se pueden colocar en cualquier parte del cuerpo y no necesariamente sobre las zonas afectadas. La clonidina, un agonista del receptor α2-adrenérgico, puede ser útil en el tratamiento de la EM al disminuir el exceso del flujo de salida simpática central, a través de los receptores α2 y contrarrestar periféricamente la vasoconstricción aberrante.
Otros tratamientos tópicos posibles incluyen el gel de diclofenac al 1% y la pomada compuesta de gabapentina al 6%. Los tópicos de venta libre que contienen alcanfor o mentol combinados con salicilato de metilo pueden ayudar a combatir e dolor durante los episodios de EM.
> Tratamiento tópico para el eritema. Los medicamentos vasoactivos que provocan vasoconstricción disminuyen el enrojecimiento durante los episodios de EM. En algunos pacientes esto da como resultado una disminución del dolor. La midodrina, un agonista α1, usada como tratamiento tópico puede ser útil. En una serie de 12 pacientes, el uso de midodrina al 0,2% aplicada 3 veces/día mejoró los síntomas de EM, incluido el enrojecimiento.
Otros medicamentos tópicos que tienen solo evidencia anecdótica para apoyar su eficacia pueden ser útil para reducir el enrojecimiento, como la oximetazolina tópica al 0,05% y el tartrato de brimonidina al 0,33%, aplicados diariamente (aprobados por la FDA para la rosácea) y el maleato de timolol al 0,5%. Su uso continuado puede producir eritema por efecto rebote.
> Terapia sistémica. Consideraciones especiales. Si los tratamientos tópicos solos no son útiles, se puede recurrir a tratamientos sistémicos. La aspirina puede ser útil, y debe ser probada en todos los pacientes que no tienen contraindicaciones.
> Aspirina. Es probable que sea efectiva a través de su mecanismo de inhibición de la síntesis de prostaglandinas y la agregación plaquetaria. Se debe explorar como tratamiento sistémico de primera línea para la EM, dado su bajo costo y un perfil de efectos adversos relativamente bajo. Para pacientes con EM que no tienen contraindicaciones para la aspirina, se administra una dosis diaria de 325 mg durante al menos 1 mes. La aspirina es especialmente efectiva en pacientes que tienen EM secundaria debido a una enfermedad mieloproliferativa subyacente, como la trombocitosis esencial y la policitemia vera. Se ha informado una mejoría espectacular ya en los primeros días del tratamiento con aspirina. Los efectos antiplaquetarios de la aspirina la hacen particularmente útil en este subgrupo de pacientes. En una serie de 57 casos, Davis et al hallaron que la mitad de los pacientes informaron que la aspirina mejoró sus síntomas, aunque otros estudios basados en encuestas no observaron mejoría de la EM. La aspirina es el tratamiento inicial más común para la EM debido a su seguridad general, accesibilidad y eficacia, en particular en pacientes con enfermedades mieloproliferativas.
> Otros fármacos no esteroideos. Para los pacientes que tienen alergia a la aspirina, estos fármacos pueden ser de utilidad. En el estudio de Davis et al, casi la mitad de los pacientes con EM que probaron ibuprofeno, indometacina, nabumetona, naproxeno o sulindac notaron que la terapia fue algo útil o muy útil. El piroxicam también ha sido utilizado con éxito en el tratamiento de la EM primaria.
> Corticosteroides. Su administración sistémica puede indicarse en un subgrupo de pacientes con EM, al comienzo del curso de la enfermedad, antes de que ocurra una posible remodelación nociceptiva irreversible y la sensibilización central. Se cree que el mecanismo de acción de los corticosteroides es suprimir cualquier componente de neuropatía inflamatoria. Aunque los mecanismos exactos de acción son inciertos, los corticosteroides pueden funcionar como estabilizadores de membrana. Una serie retrospectiva de 31 casos identificó un subgrupo sensible a los corticosteroi des entre los que tenían un claro diagnóstico precipitante quirúrgico, traumático o infeccioso, y entre aquellos en quienes la enfermedad alcanzó la intensidad máxima en menos de 21 días. Un ensayo corticoesteroide podría ser justificable para muchos pacientes que tienen EM, sin importar la edad, particularmente temprano en el curso de la enfermedad. Sin embargo, no todos los pacientes responden a los corticosteroides. Para pacientes con EM que tuvieron un inicio repentino o agudo, un desencadenante claro, o una duración inferior a 1 año, los autores recomiendan un ensayo terapéutico con corticosteroides sistémicos, para evaluar su eficacia. Se puede intentar un régimen con una dosis muy elevada. La dosis recomendada es 1 g/día de metilprednisolona por vía intravenosa, durante 3 días consecutivos y luego ,1 vez/semana durante 11 semanas, o 1 g, 1 vez/semana durante 12 semanas. Después de una prueba de 12 semanas, se debe evaluar la mejoría subjetiva y objetiva del paciente. Si el paciente tiene evidencia de mejoría con este régimen, se puede considerar el uso de agentes inmunosupresores ahorradores de corticosteroides como la azatioprina y el micofenolato mofetilo, con una disminución gradual de los corticosteroides sistémicos a lo largo de 3 a 6 meses. Para un régimen oral de dosis elevadas, los autores recomiendan una dosis diaria de al menos 40 mg de prednisona (o equivalente de corticosteroides), 5 días, durante un total de al menos menos 200 mg de prednisona. Un régimen con dosis muy elevadas puede ser más eficaz que un régimen de dosis elevadas. Se necesita más investigación para explorar la dosis ideal.
> Bloqueantes de los canales de sodio. Estos fármacos han sido investigados como un potencial y prometedor tratamiento de la EM, en especial con el descubrimiento de que la variante de secuencia del gen SCN9A que codifica la subunidad α de los canales de sodio dependientes de voltaje puede ser fundamental en la patogenia de la EM hereditaria primaria (que representa solo aproximadamente el 5% de los casos). Entre las condiciones de dolor neuropático, la EM es la única en la que la variante secuencial ha sido identificada como la causante del dolor asociado con esta condición y, por lo tanto, sirve como un objetivo potencial. La variante secuencial, una variante de ganancia de función, hace que los canales de sodio neuronales Nav1.7 se abran más fácilmente y permanezcan abiertos, lo que resulta en la activación neuronal repetida y prolongada en estas neuronas sensoriales. Incluso antes de que la variante SCN9A fuera descubierta, los bloqueantes de los canales de sodio como la lidocaína y mexiletina ya habían sido usados para tratar el dolor asociado con la EM y la lidocaína puede ser eficaz. La mexiletina, un antagonista no selectivo del canal de sodio también funciona como un antiarrítmico clase 1b. El clorhidrato de mexiletina disminuye la tasa de aumento de la acción potencial (fase 0) inhibiendo la corriente de entrada de sodio En el estudio de Davis et al, 2 de 5 pacientes con EM informaron que la mexiletina fue algo útil, mientras que los otros 3 no hallaron útil el tratamiento. En estudios in vitro e in vivo más recientes, con modelos animales, la mexiletina normalizó las propiedades aberrantes de los canales mutados Nav1.7. Se han hallado 25 informes de casos sobre la eficacia de la mexiletina oral en el tratamiento primario de la EM, incluso en casos pediátricos.
Se ha informado que la carbamazepina, otro agente oral con propiedades bloqueantes de los canales de sodio, proporciona alivio considerable del dolor, particularmente en casos de EM con variantes V400M en el Gen SCN9A tanto en los casos familiares como de novo. Específicamente, la carbamazepina normaliza la activación de las células del ganglio de la raíz dorsal que expresan canales Nav1.7 y atenúan la hiperexcitabilidad térmica de estas neuronas sensoriales.
> Estudios experimentales de los bloqueantes de los canales de sodio. Un ensayo pequeño, prueba de concepto, aleatorizado y controlado, halló que un bloqueante oral de los canales sodio dirigido al canal de sodio Nav1.7, mejora los síntomas de dolor de la EM mediados por SCN9A. Hay varios antagonistas de los canales de sodio Nav1.7 nuevos, incluyendo el tópico TV-45070 (también conocido como XEN402 y XPF-002) y el PF-05089771 oral) que, en el futuro, pueden ser terapias prometedoras para la EM primaria, aunque estos agentes están siendo sometidos a ensayos y todavía no están disponibles comercialmente. Un bloqueante selectivo de los canales de sodio Nav1.7 farmacológicamente revirtió el fenotipo inducido por neuronas sensitivas derivadas de células madre pluripotentes y bloquearon la percepción del dolor en pacientes con EM hereditaria.
> Infusión de lidocaína. Históricamente, las infusiones de lidocaína se han utilizado para los síndromes de dolor agudo. Ejemplos de infusiones de lidocaína para el control del dolor agudo de EM incluyen el uso en un paciente adulto y en un paciente pediátrico, los cuales estaban además haciendo la transición a mexiletina. Los regímenes de infusión de lidocaína varían e incluyen un régimen de dosis en bolo basada en el peso, de 1 a 2 mg/kg, una dosis en bolo fija de 50 a 100 mg, y una infusión continua de 1 mg/kg/hora. La seguridad de las infusiones de lidocaína no está clara y los efectos neurológicos (dificultad para hablar y trastornos del estado mental) son comunes. Por lo tanto, actualmente no se recomiendan las infusiones de lidocaína intravenosa para la EM. La mexiletina es una alternativa oral mucho más segura.
> Infusión de ketamina. Las infusiones de ketamina han sido utilizadas para tratar los síndromes de dolor crónico en dosis subanestésicas, con el beneficio adicional de reducir los requerimientos de opioides. Ha sido descrita como una opción terapéutica para un paciente pediátrico con EM. La ketamina se puede usar como terapia analgésica adyuvante para la EM. Algunos centros del dolor ofrecen infusiones con una combinación de ketamina y lidocaína. Aunque algunos podrían considerar una prueba de infusión de ketamina, la evidencia en su apoyo es limitaa, y su uso es controvertidopor los efectos adversos y el potencial de abuso.
> Nitroprusiato de sodio. Las infusiones con nitroprusiato de sodio han sido utilizadas en un subgrupo de pacientes con EM e hipertensión concomitante. El nitroprusiato de sodio interactúa con la oxihemoglobina para producir óxido nítrico, que finalmente conduce a la relajación del músculo liso vascular y a la disminución de la presión arterial. Varios reportes de casos de pacientes pediátricos con EM informaron una mejoría de los síntomas. Sin embargo, en una encuesta de Cohen, los síntomas de EM empeoraron en un paciente adulto tratado con nitroprusiato de sodio. Mientras están recibiendo esta infusión, los pacientes deben ser cuidadosamente monitoreados. La dosis se titula gradualmente a 2-4 mg/kg/minuto. La evidencia sobre el uso de nitroprusiato de sodio es limitada.
> Inmunoglobulina intravenosa. La inmunoglobulina intravenosa mejoró los síntomas de 2 pacientes que tenían EM secundaria, y puede ser considerada para pacientes con condiciones autoinmunes. Por lo tanto, la evidencia para este uso es limitada.
> Antidepresivos inhibidores de la recaptación de serotonina y norepinefrina. Estos fármacos han sido utilizados en el tratamiento de la EM con éxito variable. Se cree que afectan el control vascular y actúan sobre las fibras simpáticas, inhibiendo la recaptación de serotonina, norepinefrina y dopamina neuronales, y potencian la actividad de los neurotransmisores en el sistema nervioso central (SNC). Entre los medicamentos en este grupo, es el usado con más frecuencia. En un estudio piloto de 10 pacientes, la venlafaxina pareció ser relativamente segura y un tratamiento eficaz para la EM primaria, con mejoría de los síntomas después de la primera semana de tratamiento. Otro estudio también informó que 2 de 3 pacientes con EM mostraron una respuesta a la venlafaxina. La sertralina también ha sido utilizada, y en un estudio de miembros de la Erythromelalgia Association (TEA), los síntomas mejoraron en 6 de 9 pacientes tratados con sertralina. Sin embargo, la fluoxetina, otro inhibidor de la recaptación selectiva de serotonina, indujo EM en el 1 paciente. Hay pocos datos disponibles para el uso de duloxetina en el tratamiento de la EM.
> Amitriptilina. El antidepresivo tricíclico amitriptilina también inhibe la recaptación de serotonina y norepinefrina y, además, bloquea los canales de sodio. La formulación oral fue efectiva en el tratamiento de la EM en reporte de un caso. La formulación tópica ha sido combinada con ketamina.
> Anticonvulsivos.
Gabapentina y pregabalina. Estos dos fármacos han sido utilizados en el tratamiento de la EM con éxito variable. Su uso es frecuente para el tratamiento del dolor neuropático, probablemente su efecto sea a través de la unión a los canales de calcio dependientes de voltaje. La gabapentina está relacionada estructuralmente con el neurotransmisor ácido gamma-aminobutírico. La gabapentina previene la alodinia y la hiperalgesia en modelos animales, pero el mecanismo no se conoce. El régimen convencional de dosificación para iniciar la gabapentina oral es 300 mg, 3 veces/día, aunque se pueden considerar otros regímenes de dosificación alternativos, y las dosis pueden aumentarse gradualmente para lograr el efecto deseado. En la encuesta de Cohen, el total de 16 pacientes informaron mejoría pero ninguno experimentó remisión. McGraw y Kosek también notaron una mejoría en 2 pacientes con EM que fueron tratados con gabapentina. El medicamento es relativamente seguro; el efecto adverso más común es la sedación. También se informó la aparición frecuente de edema de las extremidades inferiores que puede contrarrestar los beneficios que brindan los medicamentos tópicos.
La pregabalina, un análogo del ácido gamma-aminobutírico, puede disminuir el dolor neuropático al unirse a los canales de calcio dependientes de voltaje, en el tejido del SNC. Se informaron 2 casos donde se describe la mejoría de la EM con pregabalina. En uno de los informes de casos, el paciente había recibido previamente un tratamiento de prueba con gabapentina sin mejoría, y también estaba usando tratamiento tópico.
> Prostaglandina y análogos. Estos medicamentos han sido útiles en el manejo de la EM debido a sus propiedades vasodilatadoras que disminuyen el cortocircuito arteriovenoso microvascular asociado a la con EM.
> Iloprost (administración intravenosa). Es un análogo sintético de la prostaciclina que dilata los vasos sanguíneos e inhibe la activación plaquetaria. En un estudio piloto de grupos paralelos, doble ciego, aleatorizado, 8 pacientes que reciberon iloprost por vía intravenosa tuvieron significativamente menos síntomas y menos disfunción simpática en comparación con 4 que recibieron placebo. La prostaglandina E1 y el análogo de la prostaciclina sintético iloprost se administra mediante infusiones continuas, por lo que los pacientes deben ser monitoreados de cerca.
> Misoprostol (administración oral). El misoprostol es un análogo oral de la prostaglandina E1 sintética. En un estudio doble ciego, cruzado, comparado con placebo, el misoprostol administrado por vía oral (0,4 a 0,8 mg/día) mejoró los síntomas y disminuyó el cortocircuito arteriovenoso microvascular comparado con el placebo. El efecto beneficioso del misoprostol probablemente se deba a la disminución del cortocircuito arteriovenoso microvascular en la piel afectada. En general, dada la dificultad para obtener la formulación intravenosa de iloprost en EE. UU., , se debe considerar su administración oral antes de optar por la infusión.
> Bloqueantes de los canales de calcio. Incluyen amlodipina, diltiazem y nifedipina, que han sido utilizados en la EM con respuestas variables. Algunos autores sugieren que estos bloqueantes pueden disminuir la hiperemia en la EM al inhibir las respuestas vasculares inducidas por los adrenoceptores α2-. Davis et al informaron que el 85% de 20 pacientes con EM que usaron vasodilatadores (diltiazem, nifedipina y otros) no obtuvieron ningún beneficio. En una encuesta de TEA, solo 1 paciente notó beneficio con la nifedipina, mientras que los otros tuvieron efectos adversos intolerables (por ej., diarrea), pero 6 de 8 pacientes con EM se beneficiaron del diltiazem, con casi la remisión en 1 paciente. Por el contrario, hubo casos en los que los bloqueantes de los canales de calcio indujeron EM. Según la experiencia de los autores, los bloqueantes de los canales de calcio pueden empeorar la EM mientras que su interrupción resultó en la resolución de los síntomas de EM en varios pacientes. Por lo tanto, generalmente no recomiendan su uso.
> Magnesio. El magnesio, tanto por vía oral como en formulaciones intravenosas, ha sido utilizado en el tratamiento de la EM por su propiedad bloqueante de los canales de calcio (y por lo tanto, vasodilatadora). En una encuesta de TEA, 8 de 13 pacientes tratados con dosis elevadas de magnesio oral (600-6500 mg/día) se observó una mejoría de los síntomas mientras que en 1 paciente, los síntomas de EM empeoraron. El autor de ese informe recomienda iniciar el tratamiento con magnesio en la dosis diaria recomendada (350 mg/día para las mujeres y 420 mg/día para los hombres) para ir aumentando en forma gradual, de acuerdo con la tolerancia, porque con las dosis excesivas, existe la posibilidad de que aparezcan problemas gastrointestinales por intolerancia digestiva, así como debilidad muscular, enrojecimiento, hipotensión, bradicardia, visión borrosa y efectos cognitivos. En la encuesta TEA, 2 pacientes tuvieron diarrea cuando se aumentó la dosis. En general, los productos con magnesio líquido o soluble de venta libre se toleran mejor que los comprimidos. El magnesio también puede ser administrado por vía intravenosa cada 2-3 semanas, a una dosis de 2 g infundidos durante 2 horas, pero los datos que describen la respuesta objetiva a este régimen son limitados.
> Antihistamínicos. Se pueden usar pero en general tienen un valor limitado en el manejo de la EM. Aunque la EM no parece ser una enfermedad mediada por histamina, algunos investigadores creen que una reacción local crónica puede estar involucrada, lo que justifica su uso. Se ha informado el caso de un niño con EM primaria que mejoraba parcialmente con clorhidrato de cetirizina oral. La ciproheptadina, un antihistamínico y antagonista de la serotonina, fue eficaz en aliviar los síntomas y la piel caliente de 2 pacientes con EM primaria después de no haber respondido a otros medicamentos antiinflamatorios no esteroideos, incluida la aspirina. Sin embargo, en la encuesta de Cohen, ninguno de los 3 pacientes se benefició con su administración. El pizotifeno, otro antihistamínico con actividad antagonista de la serotonina, ha sido eficaz en el tratamiento de la EM familiar. En la mencionada encuesta,2 de 3 miembros de TEA se beneficiaron de la terapia con antihistamínicos. Sin embargo, en un estudio de Davis et al, la mejoría ocurrió en menos de una cuarta parte de los 28 pacientes a los que se les prescribió antihistamínicos (clorhidrato de ciproheptadina o difenhidramina, fenilpropanolamina, trimeprazina o cimetidina). De todos los antihistamínicos, la ciproheptadina y el pizotifeno pueden ser los más prometedores debido a su propiedad adicional de bloquear la serotonina en los receptores de serotonina.
> Bloqueantes beta. Los datos limitados existentes respaldan el uso de bloqueantes beta en pacientes con EM. En el estudio de Davis et al, la mayoría de los pacientes informaron no haber recibido ningún beneficio de estos bloqueantes (atenolol, nadolol, clorhidrato de propranolol o timolol), pero, en ocasiones, los pacientes informaron una respuesta beneficiosa. Sus mecanismos de acción en la EM no han sido establecidos pero se cree que disminuyen los efectos de membrana tipo anestésico relacionados con la dosis.
> Opioides. Aunque el uso a corto plazo de opioides puede ayudar a disminuir el dolor asociado con la EM, los opioides no se consideran una opción terapéutica para la EM, dados los grandes riesgos, su potencial adictivo y la necesidad de tratamiento prolongado.
> Otros agentes. Los informes de casos han apoyado el uso de varios agentes para la EM, incluyendo ergotamina, sulodexida, pentoxifilina, busulfán, hidroxiurea, prazosin, sulfato de quinina, ranolazina, carisoprodol y pentazocina.
| Infusión epidural |
La bupivacaína y la ropivacaína son anestésicos locales que disminuyen la hiperexitabilidad de las fibras nociceptivas. La hiperexcitabilidad y el dolor disminuyen por la inhibición reversible de los canales de sodio dependientes de voltaje en las fibras nociceptivas de los ganglios del trigémino, ganglios de la raíz dorsal y fibras simpáticas.
Al interferir con la conducción de las fibras nociceptivas, la infusión epidural con bupivacaína o ropivacaína puede proporcionar alivio inmediato del dolor, pero con frecuencia es temporario. Aunque los anestésicos locales solos pueden proporcionar beneficios a los pacientes con EM, se puede agregar opioides como el fentanilo o la morfina, para lograr un efecto analgésico adicional.
Los informes sobre el uso de infusiones epidurales son escasos. Hay reportes de pacientes que tuvieron un alivio del dolor más prolongado. De 11 pacientes que recibieron infusiones epidurales para el tratamiento de la EM refractaria, 7 tuvieron una remisión completa o pudieron continuar sus actividades de la vida diaria con un dolor mínimo.
Los 4 pacientes restantes también informaron un alivio del dolor considerable, pero a largo plazo fueron necesarias intervenciones adicionales, como una segunda infusión epidural y farmacoterapia.
En 30 meses de seguimiento, una segunda infusión epidural de bupivacaína alivió todos los síntomas de 1 paciente. Aunque una segunda infusión epidural puede ser beneficiosa, la intervención farmacológica (por. ej., oxcarbazepina, pregabalina o mexiletina) después de la infusión puede ser igual de efectiva. Por lo tanto, antes de una segunda infusión, el dolor residual debe ser controlado con tratamiento farmacológico. “Nuestra experiencia”, dicen los autores, “es limitada con las infusiones epidurales para el manejo de la EM, pero no hemos observado un alivio del dolor a largo plazo, tal como ha sido descrito en informes publicados.”
| Simpatectomía |
La simpatectomía ha sido descrita en diferentes informes. Algunos resultados han sido exitosos pero otros no.
| Atención de un equipo multidisciplinario |
A menudo, los pacientes se benefician del enfoque de un equipo multidisciplinario que incluye dermatología, neurología, medicina vascular y medicina del dolor. Un enfoque multidisciplinario puede ser especialmente útil para pacientes con enfermedad grave. Para pacientes con enfermedad mieloproliferativa subyacente, la colaboración con un oncohematólogo es valiosa para manejar el trastorno subyacente.
En pacientes con neuropatía de fibras pequeñas o grandes, es importante la intervención del neurólogo. Si los pacientes tienen un sindrome de dolor crónico, la participación de un equipo de dolor y un enfoque de rehabilitación del dolor puede ser extremadamente útil.
Los pacientes con EM suelen tener un síndrome de dolor crónico con sensibilización central.
Los efectos en sus vidas pueden ser devastadores, y pueden recluirse en sus casas y adoptar comportamientos extremos para evitar precipitar los episodios de EM. Algunos pacientes están atados a una silla de ruedas y, en general, discapacitados. Para pacientes con EM refractaria cuyas vidas se han visto gravemente afectadas por la EM, o que no han tenido respuesta a otros tratamientos, se debe considerar un programa multidisciplinario para el dolor y la rehabilitación.
Los centros de rehabilitación integral del dolor ofrecen un equipo integrado por médicos, psicólogos, terapeutas ocupacionales y fisioterapeutas. Hay varios programas de rehabilitación del dolor. Según expresan los autores, “nosotros ofrecemos un programa trisemanal de tratamiento diurno con fisioterapia y terapia ocupacional. La fisioterapia está destinada al reacondicionamiento corporal y aumento de la tolerancia a las actividades.
Se abordan los problemas funcionales y conductuales de las morbilidades concurrentes. El uso de analgésicos, especialmente opiáceos, puede reducirse y suspenderse. Los autores informan los resultados de estos programas llevados a cabo en su institución, y expresan que “mejoraron el estado físico y funcionamiento emocional de los pacientes con EM grave, persistente.” Después de participar en un programa de rehabilitación del dolor de 3 semanas, un paciente que estaba confinado a una silla de ruedas debido a la EM pudo caminar y reanudar un estilo de vida activo, incluyendo jugar al golf con regularidad, un beneficio que se prolongó por años.
Recomendaciones finales
|
Traducción y resumen objetivo: Dra. Marta Papponetti
Fuente: https://www.intramed.net/
No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.