INTRODUCCIÓN
Este manuscrito pertenece a una serie de artículos que tratan sobre el papel de la disfunción de la barrera intestinal en el origen de los trastornos inflamatorios crónicos. Los artículos anteriores de esta monografía revisan las bases anatómicas, moleculares, microbiológicas, inmunológicas y fisiopatológicas que relacionan la permeabilidad intestinal con el desarrollo de enfermedades crónicas dentro del tracto gastrointestinal. Algunos estudios también apuntan a un papel destacado de las respuestas anormales a los antígenos alimentarios, microbianos y toxinas, resultantes de la alteración de la permeabilidad del epitelio intestinal, en la generación de síntomas y signos comunes a las enfermedades funcionales del tracto digestivo. Aunque la base teórica de esta hipótesis es sólida de manera aparente, es cierto que la traducción de alteraciones fisiopatológicas a manifestaciones clínicas se basa de forma principal en estudios in vitro y ex vivo y modelos preclínicos. Por lo tanto, se necesita más evidencia de ensayos clínicos para determinar su papel en el manejo de estas enfermedades.
A pesar de los avances sobresalientes en la fisiopatología y los mecanismos moleculares subyacentes a las anomalías de la barrera, no se tienen en la actualidad estándares universales para determinar con precisión la magnitud del problema. En este sentido, los parámetros de funcionales de la barrera como la relación lactulosa/manitol y quizás ciertos marcadores sanguíneos pueden ser más indicativos de la función de la barrera intestinal que los parámetros secundarios como los niveles de expresión de proteínas de unión estrecha. Esta falta de estandarización genera confusión que impide las acciones futuras de las agencias reguladoras y muchos profesionales de la salud dudan de la validez, la utilidad y la aplicabilidad clínica de las diferentes técnicas utilizadas para la determinación de la permeabilidad intestinal.
Relacionado de manera estrecha con la escasa evidencia clínica que vincula las alteraciones de la permeabilidad con los trastornos inflamatorios del sistema digestivo y otros sistemas corporales está el desarrollo insuficiente de moléculas o fármacos destinados a controlar esta función. Esto a pesar del gran número de posibles dianas terapéuticas en las que se evidenció un papel regulador tanto en la vía de los poros como en la vía de fuga. Además, la modulación de la microbiota y sus metabolitos, mediante la nutrición, también puede desempeñar un papel importante en el arsenal terapéutico de la permeabilidad intestinal alterada.
Hay cientos de publicaciones que investigan una gran cantidad de moléculas involucradas en la homeostasis de la barrera intestinal, aunque muchos datos se derivan de estudios in vitro o en animales que pueden no representar bien la situación fisiológica en el organismo humano y pueden no imitar de forma correcta la patología humana. En este artículo se revisa la evidencia relacionada con el uso de aquellas moléculas o productos que ofrecen un mayor potencial para el manejo clínico de enfermedades que se asocian de manera más consistente con la disfunción de la barrera epitelial intestinal (BEI). Los autores centran la revisión en la ruta paracelular como el principal objetivo de la ruptura de la barrera epitelial y como un evento temprano cuya pérdida de integridad funcional facilita de manera probable la penetración transepitelial del antígeno y la estimulación de las respuestas inmunológicas, lo que aumenta aún más la permeabilidad del epitelio paracelular y promueve el desarrollo de inflamación mucosa de grado bajo (Figura 1).
El mercado potencial para los productos reguladores de la permeabilidad intestinal es desconocido pero amplio de manera intuitiva. Sin embargo, queda por establecer el vínculo mecanicista entre las alteraciones en la permeabilidad intestinal y las enfermedades específicas para estimar cuántos pacientes podrían beneficiarse de mejores terapias para la permeabilidad intestinal y el costo directo e indirecto derivado de atender a estas personas.
De manera final, este manuscrito no pretende ser una revisión sistemática de la literatura sobre la permeabilidad intestinal y su manejo. Sólo quiere crear conciencia sobre el potencial de apuntar a la permeabilidad intestinal para mejorar la inflamación de la mucosa intestinal y las manifestaciones clínicas relacionadas. Sin embargo, también quiere dejar en claro que mejorar la integridad de la barrera no significa que la inflamación y la activación inmunológica se interrumpan porque esto merece más evidencia y enfoques complementarios de forma posible para manejar los defectos del microbioma y del sistema inmune.
ENFOQUE PARA EL MANEJO
Nutrientes
La nutrición tiene un papel clave en la formación de la microbiota intestinal mientras que el procesamiento de los alimentos por la microbiota intestinal libera subproductos y metabolitos que influyen en el funcionamiento de la barrera intestinal y la integridad de la capa mucosa en la salud y la enfermedad (Figura 2).
Fibras dietéticas, prebióticos y ácidos grasos de cadena corta
La Comisión Internacional del CODEX Alimentarius definió en 2009 las fibras dietéticas (FD) como “polímeros de carbohidratos con 10 o más unidades monoméricas que no se hidrolizan por las enzimas endógenas en el intestino delgado de los seres humanos”. En términos de solubilidad, las FD difieren en sus propiedades químicas. Las fibras insolubles contribuyen de manera principal al volumen de las heces, mientras que las fibras solubles se metabolizan por la microbiota del huésped, lo que también contribuye a mantener la eubiosis. De hecho, muchas de estas fibras pueden considerarse prebióticas porque son resistentes al pH ácido del estómago, no se hidrolizan por enzimas de mamíferos, no se absorben en el tracto gastrointestinal, sino que se fermentan por la microbiota intestinal, y estimulan de manera selectiva el crecimiento y/o la actividad de la microbiota intestinal, en particular Bifidobacteria y Lactobacilli, para mejorar la salud del huésped. Esto puede ser relevante ya que la disbiosis bacteriana se asocia mucho con la disfunción de la barrera intestinal y las patologías relacionadas como la enfermedad inflamatoria intestinal (EII) (ver Tabla 1). Además, la capa externa de moco se degrada a glucanos por la microbiota que consume glucanos y los glucanos reutilizados por bacterias en ausencia de suficientes FD, como se muestra en un modelo de ratón gnotobiótico, lo que puede conducir a la erosión de la barrera del moco colónico, y promover un mayor acceso epitelial y colitis letal por patógenos de la mucosa.
Estos compuestos dietéticos incluyen de manera principal fructanos tipo inulina (inulina, oligofructosa y fructooligosacáridos), galactanos, galactooligosacáridos (GOS) y otros heteropolisacáridos como quitosano, almidón, alginato, pectina o dextrano, entre otros. Se demostró que estos productos tienen un impacto positivo en la función de la barrera intestinal por medio de diferentes mecanismos después de su fermentación por bacterias no patógenas del colon. La fermentación de las FD por la microbiota intestinal libera ácidos grasos de cadena corta (AGCC). Los AGCC son ácidos carboxílicos con colas alifáticas de 1 a 6 carbonos, donde los más abundantes son el acetato, el propionato y el butirato. Los AGCC muestran una gama amplia de funciones biológicas que incluyen respuestas antiinflamatorias, la modulación de la contractilidad colónica y el mantenimiento de la actividad de las células inmunitarias de la mucosa y la integridad de la BEI, entre otras. Los AGCC, en especial en concentraciones bajas, aumentaron la resistencia eléctrica transepitelial (RETE) en las células T84 y Caco-2, lo que mejoró de manera inmediata la función de barrera del epitelio colónico por medio del microdominio rico en colesterol en la membrana plasmática y disminuyó la permeabilidad de la inulina. Estos efectos parecen estar mediados por la actividad de la proteína cinasa activada por AMP (AMPK) y el ensamblaje acelerado de las proteínas de unión estrecha (UE).
Los estudios in vitro demostraron la capacidad de las FD para atenuar la disfunción de la barrera epitelial causada por una infección bacteriana. Estudios in vitro similares con AGCC indican que los AGCC principales, el butirato, el propionato y el acetato, modulan la actividad contráctil, para mantener el ritmo circadiano. Los AGCC también pueden inhibir la producción de citocinas, activar Tregs, mejorar la BEI, al facilitar el ensamblaje de UE mediante la activación de AMPK en las monocapas de células Caco-2 y mediante el aumento selectivo de la expresión de claudina (CLDN) 3 y 4, y la activación de la síntesis de proteínas mediada por Akt/mTOR en las células IPEC-J2, lo que aumenta la RETE. De forma interesante, la activación del inflamasoma 3 de la familia NLR que contiene el dominio pirina (NLRP) induce la secreción de citocinas proinflamatorias, que se relaciona con la disfunción de la barrera. En este sentido, un estudio realizado en células CEI-6 del epitelio intestinal mostró que el ácido propiónico inhibía la activación del inflamasoma NLRP3 y preservaba la función de barrera intestinal.
El papel de las FD y los AGCC en la modulación de la función de barrera intestinal y la inflamación GI también se probó in vivo en varios modelos preclínicos y en múltiples especies. En este sentido, se demostró que el butirato de sodio revierte la permeabilidad colónica en un modelo de rata con síndrome del intestino irritable (SII). En ratones C57/BL6 sometidos a mucositis inducida por quimioterapia, la dieta alta en fibra (basada en pectina) disminuyó la afluencia de células inmunes, mejoró los parámetros histopatológicos y disminuyó la permeabilidad intestinal, en comparación con aquellos que recibieron la dieta normal. En ratones obesos, los prebióticos exhibieron menos lipopolisacáridos (LPS) y citocinas en plasma, y una menor permeabilidad intestinal y una mejor integridad de las UE en comparación con los controles. El enriquecimiento dietético con fibra de psyllium, celulosa dietética o polvo de cáscara de limón también mejoró el daño y la inflamación del colon y disminuyó la expresión de las proteínas de las UE en el modelo de colitis inducida por sulfato sódico de dextrano (SSD) en ratones, en particular durante la infancia. El polisacárido sulfatado no sólo redujo la inflamación del colon, sino que también inhibió el acortamiento y el edema del colon en el modelo de ratones. En este modelo, las FD también mejoraron la disfunción y la inflamación de la barrera intestinal. En ratones libres de gérmenes y patógenos específicos que recibieron SSD, psyllium, pectina y fibra de celulosa se redujo la gravedad de la colitis por medio de mecanismos dependientes e independientes de la microbiota, incluida la restauración de la permeabilidad intestinal. Estudios similares en ratas revelaron la capacidad de una dieta de almidón de maíz con contenido alto de amilosa para proteger contra la lesión del colon inducida por el ácido 2,4,6 trinitrobenceno sulfónico (TNBS) y mejorar la permeabilidad del colon. En el mismo modelo, el polvo de cáscara de uva con contenido alto de FD también redujo la colitis y restableció la función de la barrera intestinal en ratas Wistar. Además, se demostró que la pectina derivada de manzana modula la microbiota intestinal y la expresión de CLDN-1 en ratas obesas sometidas a una dieta alta en grasas, para atenuar la endotoxemia metabólica, la inflamación y el aumento de peso. En otros modelos de ratas, la adición de fibra de celulosa a la dieta elemental podría mejorar la falla de la barrera en el íleon en comparación con la nutrición parenteral total y la suplementación con pectina revirtió de forma significativa el aumento de permeabilidad inducido por metotrexato en el intestino delgado distal y el colon.
La FD pudo restaurar la integridad de la barrera colónica en un modelo de ratón con enfermedad renal crónica y la administración de GOS atenuó el daño de la barrera intestinal y las respuestas inflamatorias inducidas por LPS en el yeyuno y el íleon de ratones. En otros modelos, en particular en ratones carentes de IL-10 con EII, las dietas con pectina y almidón de maíz disminuyeron la respuesta inflamatoria en el colon, pero no se estableció su relación con la regulación de la permeabilidad intestinal.
La FD, como la cáscara de psyllium, pudo disminuir los movimientos intestinales y mejorar la consistencia de las heces y el aumento de peso en los perros. Además, Plantago ovata mostró eficacia para aumentar el peso corporal y la longitud del intestino delgado, así como para reducir la E. coli intestinal en pollos de engorda. Estudios recientes demostraron que el oligosacárido de alginato puede aumentar la expresión de UE, Bacteroidetes y bacterias del filo Firmicutes y disminuir las citocinas proinflamatorias en cerdos destetados.
Con respecto a los AGCC, en un modelo de rata con síndrome del intestino irritable (SII), se demostró que el butirato de sodio revierte la permeabilidad colónica. También en este modelo, se reportó que los AGCC mixtos o solos mejoran la sintomatología del SII. En el modelo de ratones neonatales con SII, diferentes concentraciones de AGCC pudieron reducir la alteración del tránsito colónico de una manera dependiente de la dosis.
En los seres humanos, las conclusiones derivadas de las intervenciones dietéticas con fibra suplementaria a menudo no son concluyentes y se ponderaron por las diferencias en el diseño y el rendimiento de los estudios, como se destaca en un metaanálisis reciente en la población con EII. Por lo tanto, la suplementación con pectina (15/día) o la suplementación diaria (12 g/día) con la FD β-glucano F y arabinoxilano de trigo no afectó la función de la barrera intestinal basal en individuos sanos jóvenes y ancianos o la hiperpermeabilidad intestinal inducida por indometacina in vivo o composición de la microbiota intestinal en ancianos, de manera respectiva. Además, la inulina enriquecida con oligofructosa (8 g/día) no mejoró la permeabilidad intestinal en niños con diabetes mellitus como tampoco la oligofructosa (6 g/día) en pacientes con quemaduras. Se demostró que las semillas de Plantago ovata mantienen la remisión en la colitis ulcerativa (CU) y fructoligosacáridos (FOS) aumentó las bifidobacterias y la IL-10 en pacientes con enfermedad celiaca (EC), aunque no se respaldó por más investigaciones. Sin embargo, se demostró que los pacientes con EC lograron una mejora en su calidad de vida y función gastrointestinal después de la ingesta de salvado de trigo. En otro estudio, voluntarios varones sanos que ingirieron inulina durante 8 semanas tenían una relación lactulosa/manitol (L/M) y zonulina sérica más bajas de forma significativa y niveles más altos de GLP-2 mucoso. Sin embargo, es importante tener en cuenta que los métodos utilizados fueron subóptimos. Por el contrario, una dieta enriquecida con polisacáridos no digeribles redujo la hiperpermeabilidad colónica inducida por la activación de las células cebadas (CC), según se determinó en las cámaras de Ussing, en ancianos que padecían estreñimiento o diarrea y una permeabilidad colónica basal elevada. De manera similar, en pacientes con enfermedad del hígado graso no alcohólico, 6 meses de intervención con fibra demostraron una reducción en los niveles de zonulina, un supuesto biomarcador sérico de permeabilidad y la suplementación con GOS redujo la permeabilidad colónica mejorada con aspirina en pacientes obesos de manera independiente de su efecto prebiótico. La combinación de plátano verde y pectina mostró buenas propiedades antidiarreicas en niños con diarrea persistente, actividad que se relacionó con la reducción de la permeabilidad del intestino delgado.
Los AGCC también pueden modular la permeabilidad intestinal en humanos. De hecho, la disminución de los AGCC plasmáticos derivados del intestino se correlacionaron con el aumento de la permeabilidad colónica en los trabajadores por turnos y los estudios organoides basados en biopsias de la mucosa colónica humana mostraron que la fermentación de 2′ ofucosilactosa, que condujo a un aumento de Bifidobacterias y un aumento de AGCC, en particular butirato, resultó en aumento significativo de la expresión de CLDN-5.
Una dieta baja en oligosacáridos fermentables, disacáridos, monosacáridos y polioles (OFDMP) se usa de forma común en el tratamiento de pacientes con SII y, en general, 52-86% de los pacientes reportaron una mejoría significativa de sus síntomas. Además, esta dieta fue más eficaz que otras (asesoramiento dietético tradicional, guías modificadas del Instituto Nacional para la Excelencia en Salud y Atención, dieta sin gluten y dieta mediterránea y una dieta simulada) y también intervenciones no dietéticas (hipnoterapia dirigida al intestino o yoga). De manera interesante, esta dieta mejoró la permeabilidad intestinal en pacientes con SII con predominio de diarrea en relación con el aumento de los niveles circulantes de vitamina (vit) D. Sin embargo, hasta la fecha, no hay más demostraciones de cómo una dieta baja en OFDMP puede interferir con la permeabilidad intestinal.
De manera reciente, una combinación de hierbas y nutrientes que incluyen curcumina, aloe vera, olmo rojo, goma guar, pectina, aceite de menta y glutamina (Gln) mejoró de forma significativa la frecuencia y la gravedad de los síntomas del tracto gastrointestinal superior e inferior en 60-80% en un estudio de tamaño pequeño de la muestra. Esta mejora se acompañó por una reducción de la permeabilidad intestinal, medida por las proporciones de lactulosa-manitol, y por cambios beneficiosos en la composición de la microbiota.
Otros factores dietéticos, como los hidrolizados de proteína de soya prebióticos sin azúcar, mostraron efectos prometedores para fortalecer la barrera epitelial en respuesta a varios disruptores de la barrera.
Vitaminas
La vitamina A y la vitamina D son micronutrientes involucrados en la regulación de la expresión de la molécula de la UE en la barrera intestinal y el sistema inmunológico de las mucosas, y dan forma a las poblaciones microbianas en el intestino. Tanto las células epiteliales como las inmunes en el tracto GI, pero no la microbiota, expresan receptores para vit A (receptor de ácido retinoico) y vit D (receptor de vit D, RVD). El RVD protege contra la inflamación de la mucosa en la colitis experimental y contribuye a la homeostasis sistémica de los ácidos biliares al regular la expresión del factor de crecimiento de fibroblastos. El receptor del ácido retinoico mejora la expresión de la Zónula Occludens (ZO)-2 que regula el receptor tipo Toll (TLR)-4 para mejorar la función de BEI en células Caco-2, así como en modelos de rata y ratón, pero no en humanos.
La presencia de vit D aumentó la RETE y preservó la integridad estructural de la UE en las células Caco-2 tratadas con SSD. En un modelo de permeabilidad de la barrera intestinal con células IPEC-J2, la vit A revirtió la disfunción de la barrera inducida por LPS mediante la mejora de la expresión de la proteínas de RETE y UE. En las células Caco-2 tratadas con LPS, para emular el daño de la barrera de la enterocolitis necrotizante (ECN), la presencia de 1,25-dihidroxivitamina D3‒forma activa de vit D‒restauró la expresión y la localización de las proteínas de la UE y revirtió la disminución de la expresión de RVD inducida por LPS. De manera probable, el daño intestinal causado por LPS en células de la línea CEI-18 y organoides mejoró después del tratamiento con vit D, al restaurar la permeabilidad y la UE. Se reportaron hallazgos similares en un modelo de enfermedad hepática alcohólica en Caco-2 retado con etanol. Además, la deficiencia de vit D puede comprometer la integridad de la barrera mucosa, y aumentar la susceptibilidad a desarrollar EII, como también se muestra en las células Caco-2.
En ratas libres de patógenos específicos, la deficiencia de vit A incrementa la gravedad de la diarrea y el daño de la mucosa intestinal. Por el contrario, durante el curso clínico de la diarrea, la suplementación con vit A alivia la diarrea y mejora el daño intestinal, lo que aumenta la expresión de proteínas de la UE. Cuando las células epiteliales intestinales de ratones deficientes en RVD se complementan con un gen trans que codifica RVD humano, la integridad de la barrera mucosa evita la respuesta hiperinflamatoria que de otro modo se observa en las células inmunes de la lámina propia de ratones deficientes en RVD.
En humanos, varios reportes indican niveles insuficientes de vit D en muchas afecciones inflamatorias, incluida la EII y el SII, con más del 50% de los pacientes afectados por hipovitaminosis. El déficit de vitamina D también se relacionó con síntomas clínicos y calidad de vida, pero la correlación entre la expresión intestinal de RVD y CLDN2 persiste controvertida. Los pacientes con enfermedad celíaca (EC) en remisión recibieron un suplemento de vitamina D‒o placebo‒durante 3 meses. Los pacientes suplementados mostraron niveles plasmáticos más altos de vit D, mejoraron los resultados de la calidad de vida y mantuvieron la permeabilidad intestinal como estaba al inicio, mientras que la permeabilidad aumentó en el grupo placebo. Como se mencionó antes, un estudio reciente evaluó la relación entre los niveles de vit D, la permeabilidad intestinal y una intervención de 12 semanas con una dieta baja en OFDMP en el SII con diarrea (SII-D). Aquellos pacientes con niveles bajos de vit D antes de la intervención, redujeron la permeabilidad del intestino delgado, aumentaron los niveles de vit D y también mejoraron los síntomas clínicos.
Aminoácidos
La vía de los poros regula, mediante la expresión de CLDN-2 mediada por IL-13, el transporte paracelular selectivo de iones (K+, Na+) y moléculas (agua) de tamaño pequeño (5-10 Å). Los estudios in vitro en células Caco-2 privadas de Gln o después de la inhibición de la sintetasa de Gln, reportaron una reducción de la RETE, un aumento de la permeabilidad y una menor expresión de las proteínas de la UE que podrían restablecerse después de la adición de Gln. La Gln, y en menor grado la arginina (Arg), también previnieron la ruptura de la barrera inducida por metotrexato en las células Caco-2. La Gln mejoró la función de la barrera intestinal en un modelo de rata de obstrucción biliar, y la Gln y la Arg evitaron la lesión de la mucosa en un modelo de isquemia-reperfusión en ratas. La Gln regula la integridad y la distribución de la UE por medio de la transmisión de señales de la proteína cinasa activada por AMP-cinasa 2 dependiente de calcio/calmodulina en células epiteliales porcinas. De manera reciente, la Gln alivió la disfunción de la barrera inducida por IL-13 al aumentar la expresión de CLDN-1, mediante la interrupción de la vía de transmisión de señales de la fosfatidilinositol-3-cinasa/Akt.
En humanos, se demostró que el microARN (miR) -29 regula la sintetasa de la Gln, la expresión de CLDN-1, el factor nuclear potenciador de la cadena ligera kappa de las células B activadas (NF-κB) y, en última instancia, el factor de necrosis tumoral (TNF-α), para regular la vía paracelular de fuga en una serie de elegantes experimentos realizados en tejidos colónicos de pacientes con SII-D. Además, en un ensayo posterior aleatorizado y controlado con placebo, los mismos autores demostraron que el suplemento de Gln (10 g/día) mejoró la permeabilidad intestinal y los síntomas principales en pacientes postinfecciosos con SII-D. Además, aunque se discute, se demostró que la suplementación enteral con Gln mejora la permeabilidad intestinal en pacientes con lesiones térmicas graves. Un ensayo aleatorizado pequeño también mostró que la Gln y la proteína de suero mejoraron la permeabilidad y la morfología del intestino delgado en pacientes con enfermedad de Crohn.
La Arg es un aminoácido semiesencial que puede metabolizarse por las arginasas del huésped y las sintasas del óxido nítrico o consumirse por las bacterias intestinales. Existen pocos estudios relacionados con Arg y la protección de la integridad de la barrera epitelial. En condiciones de estrés por calor, el pretratamiento con L-Arg revirtió de manera parcial la disminución de la RETE y el aumento de la permeabilidad paracelular. En un modelo de hipoxia en células IPEC-J2 yeyunales, la Arg evitó la reducción de la RETE y aumentó la permeabilidad paracelular de la inulina. También está disponible una gran recopilación de los últimos 30 años de ensayos clínicos realizados con Gln y Arg, que destacan una reducción de la tasa de infección y mortalidad por Gln y una disminución de complicaciones por Arg en pacientes quirúrgicos. Sin embargo, algunos de estos ensayos tienen fallas metodológicas y muchos no evalúan la permeabilidad intestinal. Por lo tanto, se necesitan más ensayos bien diseñados para justificar el uso de estos aminoácidos.
El triptófano es un aminoácido esencial también estudiado por su posible vínculo entre la microbiota intestinal desequilibrada, el deterioro de la inmunidad intestinal y el desarrollo de enfermedades. La evidencia reciente subraya que la enzima indolamina 2,3-dioxigenasa 1 expresada por el huésped es relevante para generar metabolitos indol, que se involucran en el restablecimiento de la integridad de la BEI en el contexto de las enfermedades inflamatorias intestinales y el síndrome metabólico.
Una revisión reciente sobre la suplementación con aminoácidos en lechones destetados reveló que varios de ellos (Arg, Gln, triptófano, aminoácidos que contienen azufre y aminoácidos de cadena ramificada) pueden tener un papel en el mantenimiento y la mejora de la morfología y la función intestinal, lo que aumenta la proliferación de las células epiteliales y preserva la integridad de la mucosa intestinal. En los ratones, la alteración de la barrera intestinal inducida por la radiación se mejoró con una solución de rehidratación oral a base de aminoácidos, lo que mejoró la expresión de la proteína UE y la permeabilidad paracelular.
Minerales
El zinc (Zn) es un oligoelemento esencial [10% del genoma humano codifica proteínas de unión a Zn] que desempeña un papel importante en las enfermedades diarreicas y las infecciones gastrointestinales y se relaciona de forma estrecha con la integridad de la mucosa y la BEI. La deficiencia de Zn conduce a una expresión reducida de ocludina (OCLN) y proteínas ZO-1 en células Caco-2. El agotamiento de Zn indujo la proteólisis de OCLN-3 y disminuyó la transcripción de CLDN-3 mientras que la suplementación con Zn aumentó la expresión de la RETE y ZO-1 y disminuyó la expresión de CLDN-2 y CLDN-7, lo que facilitó la expresión de OCLN y ZO-1 en células Caco2 y HT29. En ratones con infecciones bacterianas, la suplementación con Zn mejoró la protección contra la disfunción intestinal y las fugas inducidas por toxinas. El transportador de Zn, proteína 14 similar a ZRT/IRT, se expresa en las membranas plasmáticas y media la entrada de Zn en el citosol. Los ratones que carecen de la proteína 14 similar a ZRT/IRT muestran una mayor permeabilidad intestinal asociada con la expresión alterada de CLDN-1 y CLDN-2. Otros estudios demostraron que la suplementación con Cu y Zn mejoró la integridad intestinal durante la infección por Eimeria spp. en pollos de engorda. El selenio también se propuso como un buen candidato para prevenir cambios en la permeabilidad intestinal y daño mitocondrial en varias especies. En los seres humanos, la suplementación con Zn es eficaz en la prevención de la diarrea y se recomienda por la Organización Mundial de la Salud para el tratamiento de la diarrea. El Zn también tiene un efecto beneficioso sobre enfermedades infecciosas como la shigelosis, al mejorar la BEI, la absorción de nitrógeno y los síntomas. Al final, la carnosina de zinc, un complemento alimenticio saludable, estabiliza la integridad del intestino delgado y estimula los procesos de reparación intestinal después del tratamiento con indometacina, como se muestra en un ensayo controlado con placebo.
Factores basados en la microbiota
La microbiota ejerce muchas funciones cruciales, incluido el mantenimiento de la BEI.
Antibióticos
Se recomiendan antibióticos para tratar infecciones bacterianas. De manera independiente del origen de la infección, la administración de antibióticos tiene efectos adversos en la comunidad microbiana autóctona del intestino que conduce a disbiosis y micobiosis a mediano y largo plazo, con algunos efectos de composición que duran 6 meses, para facilitar la colonización por patógenos como Salmonella o Cl. difficile y para aumentar la resistencia a los antibióticos. Además, muchos antibióticos inducen cambios en la permeabilidad intestinal que pueden relacionarse con alteraciones en la diversidad α y la abundancia relativa de bacterias específicas dentro de la microbiota intestinal, como se muestra en ratas. Además, los cambios en la permeabilidad intestinal se acompañan de una reducción de los AGCC y un aumento de la actividad del inflamasoma NLRP3 y la autofagia. Por lo tanto, el uso de algunos antibióticos en los trastornos asociados con la disfunción de la barrera puede dar lugar a complicaciones adicionales, aunque estos hallazgos deben trasladarse a la clínica. Además, la biodisponibilidad de los antibióticos parece depender también de la composición de la microbiota y también de la permeabilidad intestinal.
Sin embargo, algunos antibióticos pueden tener un mejor perfil para la microbiota. La rifaximina es un antibiótico oral de amplio espectro de mala absorción que se prescribe para trastornos gastrointestinales como el SII, la EII, el sobrecrecimiento bacteriano del intestino delgado, la diarrea del viajero o la enfermedad diverticular (ED). La rifaximina parece ejercer efectos eubióticos sobre la microbiota, y aumentar la abundancia de Bifidobacterium, Faecalibacterium prausnitzii y Lactobacillus, sin cambios importantes en la composición general de la microbiota intestinal, lo que puede representar una ventaja terapéutica en entornos clínicos específicos. Además, Xu et al mostraron cómo la rifaximina oral prevenía la inflamación de las mucosas, el deterioro de la función de barrera intestinal y la hiperalgesia visceral al alterar la composición de las comunidades bacterianas en el íleon, mientras que otros antibióticos no eran tan efectivos.
Probióticos
Los probióticos son microorganismos vivos que, cuando se consumen en cantidades adecuadas, confieren un beneficio para la salud del huésped. Este beneficio se relaciona en parte con la capacidad de los probióticos para modular la BEI. Se acumuló una gran cantidad de evidencia para respaldar la eficacia de los probióticos para mejorar la rigidez y la integridad de la BEI y para modular la inflamación intestinal. Aquí solo se revisará la evidencia más representativa. Por ejemplo, Bifidobacterium pudo adherirse al moco, inhibir y desplazar la adhesión de bacterias patógenas y aumentar la integridad de la UE, al protegerlas de Escherichia coli O157:H7. La incubación de monocapas de células T84 con probióticos multiespecie evitó por completo el aumento de la permeabilidad paracelular inducido por LPS de una manera dependiente de la dosis. Este probiótico multiespecie también previno la alteración epitelial inducida por infusión intracolónica de sobrenadante fecal de pacientes con SII o por estrés de evitación de agua (EEA) en ratones C57/Bl6. Además, esta fórmula aumentó la expresión de OCLN y disminuyó la secreción de TNF-α en respuesta a LPS. De manera similar, Lactobacillus rhamnosus CNCM I-3690 previno cambios en la permeabilidad intestinal en células Caco-2 estimuladas con TNF-α y en un modelo de ratón de permeabilidad colónica aumentada, en un grado similar al de Faecalibacterium prauznitzii A2-165 en el pasado. En un modelo de ratón con SII posinfeccioso, el tratamiento con probióticos promovió la expresión de las principales proteínas de la UE CLDN-1 y OCLN en el íleon de ratón. De manera similar, Lactobacillus rhamnosus GG mejora la función de barrera intestinal en el intestino múrido inmaduro mediante la inducción de la expresión de CLDN 3. En ratones obesos y DM tipo 2, el tratamiento con Akkermansia. Muciniphila aumentó los niveles intestinales de endocannabinoides que controlan la inflamación y la barrera intestinal.
Los probióticos también pueden prevenir el daño de la barrera intestinal en condiciones de EII. Tanto LGG como una formulación probiótica que contiene Lactobacillus acidophilus, Bifidobacterium lactis, Lactobacillus plantarum y Bifidobacterium breve redujeron la alteración de la función de barrera en la colitis inducida por SSD en ratones. De manera similar, la administración de una mezcla de probióticos evitó no sólo la disminución de la expresión de las proteínas UE, sino también el aumento de la proporción apoptótica epitelial inducida por la colitis aguda. La administración oral de medio condicionado por Bifidobacterium infantis redujo la permeabilidad colónica en ratones deficientes en IL-10 en parte por medio de una mayor expresión de proteínas de CLDN-4, ZO-1 y OCLN, y una disminución de la expresión de CLDN-2. De manera similar, se demostró que Escherichia coli Nissle 1917 inhibe el intestino permeable al mejorar la integridad de la mucosa mediante el aumento de la expresión de ZO-1 en la colitis múrida por SSD. La administración de Lactobacillus rhamnosus MTCC-5897 antes de la inducción de colitis por SSD mejoró la integridad de la barrera intestinal que implica modulaciones transcripcionales de genes UE (ZO-1, OCLN, CLDN-1).
El estrés afecta de manera clara la función de la barrera intestinal y se demostró que los probióticos previenen algunos de los cambios. La ingestión de Weissella paramesenteroides WpK4 redujo la permeabilidad intestinal y redujo los comportamientos similares a la ansiedad y la depresión en ratones estresados sometidos a SSD. El Lactobacillus farciminis previno la hiperpermeabilidad intestinal inducida por el estrés y las alteraciones del moco en diferentes modelos animales. En ratas sometidas a estrés por restricción parcial, la leche fermentada que contiene Bifidobacterium lactis CNCM I-2494 previno el aumento inducido por estrés en la permeabilidad intestinal y restauró las expresiones de OCLN y JAM-A a niveles de control. De forma más reciente, Wang et al demostraron que Lactobacillus casei Zhang aumentó de manera significativa la altura de la vellosidad del yeyuno, la relación altura de la vellosidad-profundidad de la cripta, el grosor muscular y la expresión del antígeno nuclear de la célula en proliferación y las proteínas UE ZO-1 y OCLN en lechones destetados de forma precoz, y previno el daño inducido por E. coli K88 en el yeyuno. De manera similar, Lactobacillus fermentum CECT 5716 previno la separación materna y la disfunción de la barrera intestinal inducida por WAS en ratas recién nacidas, lo que redujo la permeabilidad del intestino delgado y aumentó la expresión de ZO-1.
En humanos, la administración de Lactobacillus plantarum WCFS1 en el duodeno se asoció con un aumento de ZO-1 y OCLN en sujetos sanos. Por el contrario, Lactobacillus GG redujo de forma significativa la alteración de la permeabilidad gástrica (pero no intestinal) inducida por la administración de indometacina en sujetos sanos, lo que sugiere que los probióticos son útiles para mejorar la función de barrera de una manera específica de la ubicación.
Bifidobacterium lactis CNCM I-3446 indujo una disminución significativa de la permeabilidad intestinal en bebés con ECN. En pacientes con EII, de manera particular en aquellos con reservoritis grave, la administración de una combinación de probióticos previno de forma eficaz los brotes, combinación que demostró promover la recuperación de la disfunción de la barrera intestinal inducida por IFN-γ.
De manera reciente, también se demostró que los efectos beneficiosos de los probióticos se producen mediante la liberación de vesículas extracelulares (VE). Las VE contienen una gran cantidad de compuestos activos y mediadores bacterianos que desempeñan un papel clave en las interacciones bacteria-huésped, pero también entre probióticos y otras bacterias. In vitro, el pretratamiento con VE derivadas de Akkermansia muciniphila disminuyó la producción de IL-6 de las células epiteliales del colon estimuladas por VE Escherichia coli patogénica. Las VE derivadas de Akkermansia muciniphila también protegieron de la colitis inducida por SSD en ratones C57BL/6. Además, en ratones diabéticos inducidos por una dieta alta en grasas, la administración de VE derivadas de Akkermansia muciniphila mejoró la función de la unión estrecha, redujo el aumento de peso corporal y mejoró la tolerancia a la glucosa en asociación con un aumento en la expresión de ocludina, zónula occludens y claudina-5. De hecho, en el mismo estudio, se encontraron más VE derivadas de Akkermansia muciniphila en las muestras fecales de controles sanos en comparación con pacientes con diabetes tipo 2 y el tratamiento con VE derivadas de Akkermansia muciniphila mejoró la permeabilidad intestinal en células Caco-2 tratadas con LPS, al aumentar la expresión de ocludina.
Se demostró que las vesículas secretadas por Bacteroides fragilis contienen polisacárido capsular, que induce efectos inmunomoduladores sobre las células dendríticas y previene la colitis experimental mediante las vías de transmisión de señales del TLR2. En las células Caco2, las VE de B. fragilis disminuyeron de forma significativa los niveles de ARNm del TLR2 y aumentaron de manera ligera los niveles de ARNm de TLR4 junto con un aumento de las citocinas antiinflamatorias y la inhibición del interferón (IFN)-γ. La estimulación de las células dendríticas derivadas de la médula ósea (CDMO) con VE originadas a partir de otro probiótico Gram-negativo, Bacteroides vulgatus mpk, contribuyó al silenciamiento de la respuesta inmune por medio de la inducción de un fenotipo de CDMO tolerantes.
También se demostró que la Escherichia coli Nissle 1917 (EcN) restaura la función de barrera en modelos experimentales de aumento de la permeabilidad de la barrera intestinal. La administración profiláctica de EcN resultó en una reducción de la inflamación y la preservación de la permeabilidad intestinal en un modelo múrido de colitis por SSD. El tratamiento con EcN incrementó de manera significativa la expresión colónica de las proteínas de unión estrecha ZO-1 y ocludina, lo que preservó la capa mucosa y restauró la permeabilidad intestinal. La administración oral de VE EcN purificadas antes de la ingesta de SSD, redujo de forma significativa los síntomas clínicos y las puntuaciones histológicas en un modelo de ratón con colitis inducida por SSD. De manera similar, en las líneas celulares de colon, las VE EcN promovieron el aumento de la expresión de ZO-1 y claudina-14, e indujeron la expresión de IL-22 lo que reforzó la barrera intestinal.
Sin embargo, pocos estudios abordan de manera específica la permeabilidad intestinal in vivo en humanos. Un estudio evaluó la eficacia de una mezcla de probióticos en la permeabilidad intestinal, la función inmunológica y en la prevención del síndrome de disfunción multiorgánica en pacientes enfermos críticos. Encontró que los pacientes respondieron con un aumento significativo en las concentraciones sistémicas de IgA e IgG y, en la mayoría de ellos, la permeabilidad intestinal disminuyó, en comparación con el placebo o los sonicados. Mujagic et al evaluaron los efectos de Lactobacillus plantarum sobre la función de barrera del intestino delgado mediante la relación lactulosa-ramnosa después de la ingesta de indometacina, pero no hubo ningún efecto significativo. Sin embargo, en biopsias de intestino delgado, L. plantarum TIFN101 moduló las vías de transcripción génica relacionadas con la adhesión célula-célula con un recambio alto de genes implicados en la síntesis y la degradación de proteínas de unión estrecha y adhesión. Un metaanálisis reciente evaluó el efecto de los probióticos/simbióticos sobre los niveles séricos de zonulina, como una medida de la permeabilidad intestinal, y mostró efectos favorables, aunque los resultados deben interpretarse con cautela debido a la heterogeneidad alta. Otro metaanálisis reciente destaca también el posible papel beneficioso de los probióticos en la mucositis gastrointestinal y la reducción de la permeabilidad intestinal y el mantenimiento de la capa mucosa.
En conjunto, todos estos datos sugieren que los probióticos mejoran la rigidez y la integridad de la barrera intestinal mediante varios mecanismos, y que la restauración de la mucosa tiene un impacto positivo en el curso clínico de la enfermedad. Sin embargo, se necesitan estudios específicos que midan la permeabilidad intestinal por medio de un método validado para lograr conclusiones más sólidas.
Moléculas farmacéuticas bioactivas y estrategias terapéuticas basadas en péptidos de transmisión de señales
Péptido 2 similar al glucagón
El péptido 2 similar al glucagón (GLP-2) es un péptido intestinal derivado del proglucagón que ejerce su función por medio del receptor GLP-2 (GLP-2R), expresado de manera predominante en el tracto intestinal. El GLP-2 endógeno promueve el crecimiento intestinal después de un período de ayuno o en respuesta a la enteritis. El GLP-2 exógeno ejerce efectos profundos al expandir el epitelio de las criptas-vellosidades mediante una mayor proliferación y supervivencia, para aumentar la digestión, la absorción y el flujo sanguíneo de nutrientes.
El GLP-2 también mejora la función de la barrera intestinal tanto en condiciones de salud como en modelos de enfermedad, lo que reduce el transporte paracelular de iones y moléculas pequeñas e inhibe de forma drástica la captación de macromoléculas endocíticas en ratones. La administración crónica de GLP-2 mejora la función de la barrera intestinal y disminuye la permeabilidad de la barrera epitelial. De hecho, el modelo GLP2 en ratones disminuye el paso transcelular de iones, 51Cr-EDTA e isotiocianato de fluoresceína, así como la endocitosis de peroxidasa de rábano picante (PRP), un marcador de permeabilidad transcelular. Los siguientes estudios demostraron que esta capacidad es dependiente de GLP-2R, en asociación con un aumento de la expresión de la UE, de manera más notable CLDN-3 y 7. Además, las ratas que recibieron GLP-2 exógeno subcutáneo mostraron menos daño estructural intestinal, vellosidades intestinales más largas y mayor expresión de inmunoglobulina (Ig) A, en un modelo de ictericia obstructiva.
Se reportó de forma amplia sobre el efecto del GLP-2 sobre el aumento de la longitud de las microvellosidades, sin embargo, no se comprende bien cómo se logra esto. De manera reciente, Markovic et al demostraron que el aumento de la longitud de las microvellosidades con el tratamiento con GLP-2 requiere el receptor del factor de crecimiento 1 similar a la insulina del epitelio intestinal (IE-IGF-1R) en ratones. La villina, una proteína de unión a actina, se regula por la vía GLP-2-IE-IGF-1R. La villina tiene un papel bien establecido en la reparación de heridas epiteliales, tanto con el factor de crecimiento de insulina 1 como los niveles disminuidos de villina en la enfermedad de Crohn. Estos hallazgos sugieren un nuevo mecanismo por el cual el GLP-2 puede atenuar la enfermedad de Crohn y/u otras patologías inflamatorias. Estos resultados son consistentes con investigaciones previas que ya demostraron los efectos del GLP-2 por medio de las proteínas UE intestinales moduladoras de IE-IGF-1R. Al respecto, un estudio en pacientes pediátricos con EC ileal aguda mostró que estos pacientes tienen una disminución de la liberación de GLP-2 posprandial y una mayor permeabilidad intestinal. La curación de la EC se asoció con la normalización de la liberación de GLP-2 posprandial y la permeabilidad intestinal. De manera más reciente, también se describió una liberación anormal del péptido 2 similar al glucagón posprandial en pacientes adultos con enfermedad de Crohn.
Al final, el análogo de GLP-2 teduglutida se introdujo con éxito en la práctica clínica como un nuevo tratamiento para el síndrome del intestino corto dependiente de la nutrición parenteral. Puede aumentar de forma eficaz la capacidad de absorción intestinal residual mediante la inducción de la hipertrofia y la hiperplasia de la mucosa intestinal, el aumento de la perfusión intestinal y la reducción de la motilidad intestinal y la secreción de ácido gástrico, para lograr una reducción de la nutrición parenteral. De manera reciente, se describieron varios casos de enfermedad de Crohn activa y síndrome del intestino corto tratados con éxito con teduglutida. Sin embargo, no hay datos sistemáticos sobre el tratamiento con la teduglutida no aprobada en la EC grave activa, ya que su actividad inflamatoria fluctuante puede considerarse de mayor riesgo.
Todos estos hallazgos apoyan el tratamiento con GLP-2 como una posible terapia eficaz para mejorar, mantener o recuperar la función normal de la barrera en los trastornos intestinales. Sin embargo, hasta la fecha, no existen estudios en humanos que evalúen el efecto del GLP-2 sobre la permeabilidad intestinal. No obstante, la teduglutida debe utilizarse con precaución y suspenderse en caso de neoplasia intestinal debido a su efecto sobre la proliferación epitelial intestinal.
Factor liberador de corticotropina
El factor liberador de corticotropina (FLC) es un péptido de transmisión de señales, secretado tanto en el sistema nervioso central como en la periferia, como en el tracto gastrointestinal, que estimula la secreción de la hormona adrenocorticotrópica de la glándula pituitaria en respuesta al estrés. El FLC y las moléculas relacionadas, como las urocortinas 1, 2 y 3, participan de manera amplia en la regulación de cambios motores, sensoriales y de permeabilidad mediados por estrés en el tracto GI, en modelos animales y humanos, y actúan mediante los receptores de FLC acoplados a proteína G (FLC-R) 1 y FLC-R2.
Muchos autores describen los efectos del estrés sobre la permeabilidad intestinal. Los estudios en ratas y cerdos demostraron que los cambios inducidos por FLC sobre la función de la barrera eran equivalentes a los provocados por el estrés. Entre otras alteraciones, el FLC induce el engrosamiento de la capa de moco, mejora la conductancia y el flujo macromolecular transepitelial y paracelular, la reorganización de la UE y la activación del sistema inmunológico en el intestino delgado y el colon. Evidencia consistente indica que muchos de estos mecanismos se impulsan de manera predominante por la activación y la desgranulación de las CC, aunque estudios recientes hacen hincapié en los eosinófilos como contribuyentes potenciales a la disfunción intestinal mediada por estrés, de forma específica en pacientes con SII-D. Se observan efectos opuestos de FLC-R1 y FLC-R2 en la función de barrera de la mucosa intestinal mediada por estrés en cerdos, con FLC-R2 que previene los cambios de permeabilidad y FLC-R1 los mejora.
De manera interesante, el estrés crónico demostró cómo el deterioro de la barrera podría ser persistente si se repite el factor estresante. Vicario y colaboradores reportaron aumento de la permeabilidad epitelial intestinal, hiperactivación del eje hipotalámico-pituitario-adrenal e inflamación reversible en ratas sometidas a estrés repetido o FLC, que desarrollaron de forma posterior hipersensibilidad visceral. De manera similar, el FLC y la sauvagina, un péptido similar al estrés, incrementaron el flujo intestinal de iones y macromoléculas, que podría inhibirse por la astresina, un potente inhibidor inespecífico del FLC, y el doxantrazol, un estabilizador de las CC. Las alteraciones de la permeabilidad intestinal provocadas por varios factores estresantes o FLC se inhiben por antagonistas del receptor peptídico de FLC y antagonistas selectivos de FLC-R1. Además, Nozu et al reportaron de manera reciente en un modelo de SII en ratas que la imipramina inhibía de forma dependiente de la dosis la hipersensibilidad visceral, la hiperpermeabilidad colónica y otros efectos gastrointestinales del FLC o el estrés repetido mediante los receptores adrenérgicos α2, los receptores de dopamina y opioides.
En humanos sanos y pacientes con SII, los estudios funcionales también demostraron que el FLC periférico reproduce en gran medida el aumento de la motilidad colónica, la permeabilidad intestinal, la activación de las CC y la hipersensibilidad visceral observada en animales. Los cambios en la permeabilidad intestinal y colónica se mediaron por la activación de las CC y se revertieron por cromoglicato disódico, otro estabilizador de las CC. No obstante, a pesar de generar una gran expectativa desde el principio, y de varios ensayos clínicos realizados con varios antagonistas de FLC, de manera desafortunada, hasta la fecha, esto no se tradujo en la práctica clínica para el manejo del SII inducido por estrés.
Anticuerpos humanizados contra el factor de necrosis tumoral α
El factor de necrosis tumoral α (TNF-α) y la cinasa de cadena ligera de la miosina (CCLM) son los principales reguladores de la vía paracelular de fuga. El TNF-α es una citocina proinflamatoria multifuncional que tiene efectos amplios sobre las células y las estructuras relacionadas con la función de la barrera intestinal. Es probable que uno de los efectos de deterioro de la barrera provenga de la capacidad del TNF-α para inducir la apoptosis. Sin embargo, se encontró que el TNF-α deteriora la integridad paracelular incluso en presencia de un bloqueador de la apoptosis, lo que sugiere mecanismos adicionales involucrados. De hecho, los estudios in vitro encontraron que el TNF-α modula la estructura de la UE al romper las hebras de ZO-1 y modificar así la estructura de la barrera epitelial. La estimulación con TNF-α también podría aumentar la permeabilidad al inducir la expresión de la proteína CLDN-2 de las UE formadora de poros. También hay pruebas de que el TNF-α aumenta la permeabilidad paracelular al activar la transcripción, la expresión, la actividad enzimática y el reclutamiento de la CCLM larga en el anillo de actomiosina. La activación de la CCLM desencadena la contracción del anillo de actomiosina perijuncional que conduce a la reorganización molecular de la estructura de la UE, incluida la endocitosis de la OCLN.
El uso de anticuerpos monoclonales contra TNF-α mostró resultados mixtos, algunos de los cuales demostraron ser exitosos para inducir la remisión en casos de EII, pero también a costa de eventos adversos y un número alto de no respondedores a lo largo del tiempo. Pocas, pero prometedoras pruebas sugieren que dirigirse al TNF-α puede mejorar partes específicas de la función de la barrera intestinal y los signos endoscópicos en el tejido de la mucosa, lo que en conjunto se denomina curación de la mucosa.
El adalimumab es un anticuerpo monoclonal contra el TNF-α que demostró que mejora tanto la BEI como las características clínicas en pacientes con EII. El cultivo de células de colon humano mostró que el uso simultáneo de TNF-α e interferón (IFN-γ) interrumpió la barrera epitelial, lo que provocó una caída significativa de la RETE, la aparición de irregularidades en las estructuras de UE, la interrupción de la OCLN y el aumento de la fosforilación de MLC. Todos estos efectos se revirtieron con la administración de Adalimumab. Al someter un modelo de células 3D Caco-2 a plasma de pacientes con enfermedad de Crohn activa, la permeabilidad paracelular aumentó a través de la degradación de ZO-1 y OCLN.
El infliximab, un anticuerpo monoclonal quimérico contra el TNF-α soluble y unido a la membrana, mostraron resultados satisfactorios tanto en pacientes con enfermedad de Crohn como con CU. Los pacientes con enfermedad de Crohn muestran una mayor permeabilidad inicial en comparación con los controles sanos, que se normalizó después de un tratamiento de 7 días con infliximab, para una disminución final de 10 veces de la relación lactulosa/manitol. El efecto de Infliximab sobre la función de barrera también se investigó mediante el montaje de biopsias de colon no inflamadas de pacientes con enfermedad de Crohn en cámaras de Ussing y en células Caco-2. Los resultados mostraron una disminución significativa en la permeabilidad paracelular y la normalización de la permeabilidad transmucosa a niveles cercanos al control para la Escherichia coli invasora adherente. La eficacia de infliximab no se estudió bien para otras afecciones caracterizadas por disfunción de la barrera intestinal. Sin embargo, la terapia anti-TNF-α es un medicamento de rescate común para las condiciones diarreicas refractarias a la terapia con esteroides, incluida la diarrea relacionada con el sistema inmunológico después de la terapia con inhibidores de puntos de control inmunitarios o la colitis microscópica. Un estudio de caso de un paciente con EC refractaria mostró una mejoría en los síntomas e histología intestinal después del tratamiento con Infliximab, lo que sugiere un posible efecto sobre la función de barrera.
La inhibición de la expresión de CCLM o la actividad enzimática da como resultado una toxicidad sistémica que hace que estas moléculas no sean adecuadas como dianas terapéuticas para el control de la barrera. Sin embargo, de manera reciente una nueva molécula, denominada divertina previene el reclutamiento de CCLM1 al anillo actomiosina sin inhibir la función enzimática. De esta manera, la divertina restaura la disfunción de la barrera inducida por TNF y previene la progresión de la enfermedad en la EII crónica experimental.
En conjunto, estos resultados indican que la curación de la mucosa y la remisión clínica en pacientes con EII pueden relacionarse mucho con los efectos inmunomoduladores del bloqueo del TNF-α, con perfeccionamientos en la función de la barrera intestinal que ocurren como efectos secundarios que mejoran de manera sinérgica el resultado.
Interferón-gamma (IFN-γ)
El interferón tipo II (IFN-γ) se conoce de manera amplia como una citocina proinflamatoria con efectos potentes sobre la función de la barrera intestinal. Los estudios realizados in vitro encontraron que el IFN-γ influye en la permeabilidad paracelular al afectar las propiedades estructurales de la barrera epitelial. Se demostró en líneas celulares T84 colónicas que el IFN-γ puede internalizar las proteínas UE OCLN, CLDN-1, CLDN-4 y la molécula de adhesión A de unión, para disminuir así la RETE y aumentar el paso de marcadores paracelulares. Se descubrió que el proceso de internalización implica la contracción del citoesqueleto de una manera independiente de CCLM, lo que lo separa de los mecanismos del TNF-α mediante efectos más directos sobre la integridad de la barrera, aunque el resultado final es similar. Las técnicas modernas in vitro que utilizan organoides intestinales (modelos de cultivo celular 3D) verifican aún más la capacidad del IFN-γ para alterar la función de la barrera epitelial por medio de la degradación y la deslocalización de la proteína de las UE. Varios estudios muestran un efecto deletéreo sinérgico sobre la función de barrera intestinal de la combinación de IFN-γ y TNF-α. Uno de los mecanismos detrás de este efecto sinérgico podría provenir de la capacidad del IFN-γ para aumentar la expresión del receptor 2 del TNF, como lo demuestra la restauración de la función de la barrera cuando se bloquea el receptor 2 del TNF, pero no el receptor 1 del TNF. De manera inversa, también se demostró que el TNF-α aumenta la expresión in vitro del receptor del IFN. El IFN-γ se incrementa en muchas afecciones intestinales que también se caracterizan por una disfunción de la barrera intestinal, como la EII y el SII. A pesar de varios intentos de crear anticuerpos para IFN-γ o sus receptores, la aplicabilidad clínica es difícil debido a su ubicuidad en células y órganos y sus efectos pleiotrópicos. De todos modos, está en desarrollo un anticuerpo monoclonal contra el IFN-γ, AMG 811.
Anticuerpos humanizados contra la interleucina-13
La IL-13 es una citocina muy involucrada en reacciones inflamatorias y se produce de manera principal por células T helper-2, CC, eosinófilos y células asesinas naturales. El efecto de la IL-13 sobre la función de la barrera no se estudió de forma amplia, pero los experimentos in vitro que utilizan líneas de células epiteliales colónicas demostraron aumento de la expresión de la proteína CLDN-2 de las UE formadoras de poros junto con un aumento de la permeabilidad paracelular. La activación de CCLM puede conducir a un aumento de la producción de IL-13 mucosal junto con un aumento de la expresión de CLDN-2 en ratones. Además, la IL-13 también comparte con el TNF-α la capacidad de inducir la apoptosis epitelial y este efecto puede potenciarse mediante la estimulación de ambas citocinas de forma simultánea, lo que sugiere un posible efecto sinérgico.
Se encontró una mayor expresión de IL-13 en las células mononucleares de la lámina propia de pacientes con enfermedad de Crohn y colitis ulcerosa (CU). En el mismo estudio, la estimulación con IL-13 mostró una RETE disminuida en un modelo de cultivo celular de células HT-29/B6 y por un aumento en la CLDN-2 de las UE formadoras de poros, mientras que los niveles de ZO-1 y OCLN no se afectaron. Además, también encontraron una permeabilidad mayor de forma significativa de las sondas de azúcar lactulosa y manitol, y una tasa mayor de apoptosis in vitro. Aunque la reportación sobre los niveles de IL-13 en las mucosas en pacientes con SII es escasa, hay resultados que muestran que los niveles séricos de IL-13 aumentan de forma significativa en pacientes con CU con síntomas similares al SII. Sin embargo, el papel de la IL-13 en la fisiopatología de los trastornos inflamatorios intestinales es controvertido, ya que los estudios clínicos posteriores con anticuerpos monoclonales contra la IL-13 (tralokinumab, anrukinzumab) en la CU no lograron reportar resultados convincentes. Estos estudios no investigaron ningún parámetro directo de la función de la barrera intestinal, como la permeabilidad o la expresión del gen/proteína de las UE, por lo que es posible que los agentes anti-IL-13 pudieran afectar dichos parámetros, e imitar los estudios in vitro, pero de manera ineficaz. El agente anti-IL-13 lebrikizumab parece tener efectos positivos en pacientes con dermatitis atópica, una enfermedad inflamatoria crónica de la piel caracterizada por defectos de la barrera cutánea. Aunque los mecanismos detrás de la mejora podrían vincularse de manera especulativa con la restauración de la función de barrera de la piel, hasta donde se sabe, ningún estudio dilucida tales mecanismos. Es probable que los efectos antiinflamatorios de la inhibición indirecta de la IL-13 también ayuden a mantener la integridad de la barrera hasta cierto punto. Sin embargo, estos resultados no parecen sugerir que apuntar sólo a la IL-13 sea una opción eficaz en el tratamiento de las afecciones de la disfunción de la barrera intestinal. Dado que múltiples citocinas pueden tener efectos deletéreos sobre la función de la barrera, es posible que inhibir varias citocinas al mismo tiempo tenga efectos más fuertes.
Larazotida
El acetato de larazotida, también conocido como AT-1001, es un péptido sintético derivado de la toxina Vibrio cholerae zonula occludens (ZO-T o zonulina) que se comporta como un antagonista de la zonulina y se propone como regulador de la permeabilidad. La zonulina se libera por las células epiteliales intestinales después de la dieta o los estímulos de la microbiota. El desprendimiento de la proteína ZO-1 del complejo proteico de las UE mediado por zonulina tiene un efecto directo en el aumento de la permeabilidad intestinal. La larazotida previene la apertura de UE, lo que puede bloquear de forma local los receptores de zonulina, y unirse a los receptores en sí, disminuir el desprendimiento de las UE y promover el ensamblaje de las UE y el reordenamiento de los filamentos estructurales. La larazotida se desarrolló para el tratamiento de la EC y luego se probó en diabetes tipo 1, enfermedad inflamatoria intestinal, enfermedad de Kawasaki, enfermedades respiratorias, artritis inducida por colágeno y lesión isquémica intestinal.
Se publicaron cuatro ensayos clínicos que utilizaron acetato de larazotida, todos en EC. Estos estudios confirmaron su seguridad y eficacia para reducir los síntomas inducidos por el gluten, así como un interesante efecto de dosis inversa, es decir, una mayor reducción de los síntomas con dosis más bajas. Sin embargo, los resultados positivos no pueden relacionarse con una reducción de la permeabilidad del intestino delgado, medida por la prueba de lactulosa-manitol, debido a la enorme variabilidad, lo que lleva a resultados controvertidos. Se lleva a cabo un ensayo de fase 3 (ClinicalTrials.gov Identifier: NCT03569007) para probar la larazotida en dosis más bajas en pacientes con EC que siguen una dieta sin gluten. Por tanto, aunque se observó algún beneficio clínico, se necesita una evaluación más precisa del efecto de larazotida sobre la permeabilidad intestinal, no sólo en la EC sino también en otras patologías con disfunción de la barrera intestinal paracelular.
Lubiprostona
La lubiprostona (LBP) es un derivado de la prostaglandina E1 capaz de unirse y activar el canal de cloruro tipo 2 (ClC-2) ubicado en el lado luminal del epitelio, para mejorar la frecuencia intestinal y la consistencia de las heces en pacientes estreñidos con SII. Además, se reporta que la LBP mejora la función de barrera intestinal, revierte la disminución de la RETE inducida por IFNγ y el aumento en la permeabilidad del dextrano marcado con fluoresceína y mejora la expresión de CLDN-1 in vitro.
La LBP redujo la gravedad de la colitis y la permeabilidad intestinal en la colitis inducida por SSD y TNBS en modelos múridos. De manera alternativa, cuando se administró LBP a ratones carentes de ClC-2, se limitó el efecto protector contra la colitis por SSD, lo que sugiere un papel central de los canales de cloruro en la restauración de la función de barrera y la arquitectura de UE impulsada por la LBP. La LBP también redujo el flujo de manitol en el intestino lesionado por isquemia en modelos porcinos ex vivo, y disminuyó la hiperalgesia visceral inducida por estrés por evitación crónica del agua en ratas, en parte por la disminución de la expresión de OCLN y también el aumento de la expresión de CLDN-2 en criptas de colon de ratas. El potencial de la LBP para prevenir la lesión del intestino delgado y el aumento de la permeabilidad relacionada con los fármacos antiinflamatorios no esteroides se reportó en un modelo de rata.
Un estudio evaluó el efecto de la LBP sobre la función de la barrera intestinal humana después de la administración de diclofenaco, y mostró una reducción significativa de la relación lactulosa-manitol en comparación con el grupo de control. De manera desafortunada, los tres ensayos aleatorizados que apoyan el uso de LBP en el SII con estreñimiento no evaluaron la permeabilidad intestinal como criterio de valoración.
Dexmedetomidina
La dexmedetomidina (DMM) es un agonista de adrenorreceptores 2 muy selectivo, que se utiliza como adyuvante sedante y anestésico. De manera interesante, también muestra un papel protector contra la disfunción de la barrera y la lesión intestinal. Sin embargo, los mecanismos exactos no se aclararon del todo, aunque es capaz de acelerar la cicatrización de heridas intestinales al aumentar la proliferación de células epiteliales intestinales. El pretratamiento con DMM redujo la lesión intestinal en un modelo de rata de isquemia intestinal y también mejoró la disfunción microcirculatoria intestinal y la disfunción de la barrera en ratas endotoxémicas en asociación con una reducción de la escisión de OCLN y el influjo bacteriano en el bazo. Después de una lesión cerebral traumática, la disfunción del sistema gastrointestinal y el deterioro de la función de barrera son características comunes. El DMM pudo reducir las citocinas inflamatorias sistémicas y la disfunción de la barrera, y mejorar la estructura de las vellosidades en un modelo de rata de lesión cerebral. El DMM también demostró proteger contra la respuesta inflamatoria inducida por el golpe de calor y la disfunción multiorgánica. La DMM también demostró capacidad para revertir la hiperpermeabilidad epitelial intestinal inducida por quemaduras al reducir la inflamación y mejorar la expresión y distribución de las proteínas UE ZO-1 y OCLN.
En humanos, un ensayo aleatorizado y doble ciego que utilizó DMM perioperatorio o placebo en pacientes que se sometieron a una hepatectomía no sólo mostró una disminución de los biomarcadores relevantes de forma clínica de lesión intestinal, sino también una reducción de las puntuaciones de insuficiencia intestinal a las 72 h después de la cirugía. En otro estudio prospectivo aleatorizado, doble ciego, la DMM mejoró la recuperación gastrointestinal y redujo las lesiones intestinales y la permeabilidad, reflejada por la disminución de la diamino oxidasa sérica y la expresión de proteínas de unión a ácidos grasos intestinales. Un estudio prospectivo doble ciego aleatorizado reciente sugiere que la DMM es un anestésico más adecuado para pacientes sometidos a cirugía gastrointestinal, ya que se asocia con una disminución de TNF-α y D-lactato junto con un aumento en la activación de α7nAChR.
Estabilizadores de células cebadas y flavonoides
Los células cebadas (CC) intestinales desempeñan un papel esencial en la regulación de la función de barrera y la homeostasis intestinal, como se muestra tanto in vitro, como en modelos animales y en humanos, que se revisó en otra parte. La activación de las CC conduce a la liberación de una amplia variedad de mediadores proinflamatorios y reguladores, y muchos de ellos tienen un efecto sobre la barrera intestinal y modulan la respuesta inmune y el sistema nervioso entérico. Aunque la inhibición de la activación de las CC se investigó de forma amplia y son posibles muchos enfoques diferentes, el uso de estabilizadores de las CC ganó cierta consideración en el tratamiento de varios trastornos intestinales en humanos, de manera principal debido a su papel beneficioso en la regulación de la BEI se basa en una literatura amplia y sólida en modelos preclínicos. Entre los estabilizadores de las CC, sólo se trasladaron a la clínica el ketotifeno y el cromoglicato disódico (CGDS).
Hay pocos estudios que exploren el efecto de los estabilizadores de las CC en la modulación de la BEI en humanos. En un estudio, el ketotifeno pudo restablecer la permeabilidad gastrointestinal en un pequeño grupo de pacientes con alergia alimentaria. En un ensayo con pacientes con SII, el ketotifeno redujo varios síntomas de SII, aunque no se exploró la función de la barrera. Aunque de modo preliminar, el ketotifeno también mostró beneficios significativos para el tratamiento del íleo posoperatorio, una condición que también parece relacionarse con la disfunción de la BEI. El CGDS revirtió el aumento de la permeabilidad intestinal provocado por el FLC o el estrés en voluntarios sanos. De forma previa, el pretratamiento con CGDS redujo la permeabilidad intestinal inducida por la leche, en niños con alergia a la leche de vaca o alergia a los alimentos, y en pacientes con eccema dishidrótico, pero no en el eccema atópico, aunque estos estudios se realizaron en grupos pequeños. Varios otros estudios demostraron la utilidad potencial del CGDS para el tratamiento del SII, pero de nuevo, hay poca evidencia clínica disponible para apoyar su uso como un posible modulador de la BEI.
Los flavonoides son sustancias naturales con estructuras fenólicas variables que se encuentran de manera común en frutas, verduras, té, vino, granos, corteza, raíces, tallos y flores. Los flavonoides presentan una actividad antioxidante, antimicrobiana, citoprotectora y antiinflamatoria natural. Múltiples estudios in vitro muestran la capacidad de varios flavonoides, incluida la 8-prenilnaringenina, antocianinas, berberina, puerarina, genisteína, kaempferol, naringenina, quercetina y luteolina, entre otros, para restaurar la disfunción de la barrera, de manera predominante en las células Caco-2. Además, se describe su capacidad para incrementar la expresión, ensamblaje y producción de diferentes proteínas de las UE como ZO-1 y 2, OCLN y CLDN 1, 3 y 4 mediante la activación de AMPK y la inhibición de NAPDH oxidasa/NF-γB y CCLM y fosforilación de MLC. Los estudios in vivo en ratas destacan el efecto de los flavonoides en el aumento de la expresión de varias vías involucradas en la expresión de varias proteínas UE 1. En humanos, se está a la espera de ensayos clínicos en curso para determinar el papel de los flavonoides naturales en el manejo de la disfunción de la BEI.
Glucocorticoides
Los glucocorticoides (GC) desempeñan un papel importante en el mantenimiento de la homeostasis por medio de acciones antiinflamatorias e inmunosupresoras, mediadas de manera principal por receptores de GC. Los derivados sintéticos de GC son esenciales en el tratamiento clínico de enfermedades inflamatorias y autoinmunes.
Los GC se liberan después de la ruptura de la barrera, en parte para neutralizar el efecto del TNF, mediante la inhibición de la actividad de CCLM. En el mismo modelo in vitro, los GC desencadenaron un aumento de la RETE dependiente del tiempo y de la dosis de una manera dependiente del receptor de GC, aunque no se observaron cambios en la arquitectura de las UE. Los GC también regularon la expresión de CLDN por medio de MKP-1 en líneas celulares, pero también en criptas mucosas de colon de humanos y ratas. Además, se describió que los GC modulan la expresión de varias otras moléculas relacionadas con la polarización y el desarrollo de las UE. Una interacción entre los GC y la IL-10 p38 MAPK mejoró la integridad de la barrera después de la exposición al TNF-α en un modelo de Caco-2. La deficiencia del receptor GC agravó la integridad de la barrera en un modelo animal de colitis.
Los GC redujeron la permeabilidad intestinal en un gran número de pacientes, de forma principal en la enfermedad de Crohn, pero también en el recto de pacientes con colitis colagenosa. Además, el efecto de los GC sobre la permeabilidad no se limita a la BEI ya que se demostraron efectos moduladores similares en el epitelio pulmonar y la barrera hematoencefálica. Además, se propuso el uso de GC para tratar la inflamación intestinal durante la sepsis para reducir la disfunción de la barrera intestinal. Por último, los pacientes con CU presentan niveles reducidos del homólogo 1 del receptor hepático (HRH-1) en el colon. El HRH-1 participa en la sustitución del factor 1 esteroidogénico adrenal y la síntesis de GC en la médula suprarrenal. Un estudio reciente demuestra cómo la restauración de HRH-1 restableció la integridad epitelial en organoides de ratón y humanos, así como su sobreexpresión protegió a los ratones de desarrollar colitis.
Mucoprotectores
Los mucoprotectores son compuestos de diferente naturaleza (sales insolubles, hemicelulosa, ácido tánico, gelatinas...) con la capacidad de potenciar la barrera intestinal al crear una barrera filmógena sobre la mucosa intestinal, y ayudar a reducir el efecto de patógenos y para mejorar la función de la barrera intestinal. Estos compuestos actúan dentro del lumen para modificar los contenidos entéricos y pueden representar una terapia alternativa o complementaria para tratar los trastornos diarreicos agudos y crónicos.
Xyloglucano
El xyloglucano (XG) es una hemicelulosa de polisacárido ramificado de peso molecular alto, soluble en agua. El XG ayuda a reducir los cambios de permeabilidad, preservar la UE y la invasión de E. coli en las células Caco2/células de Goblet, y la unión a MUC1, en ratones expuestos a SSD. El XG no es tóxico y es resistente a las enzimas digestivas, llega inalterado al colon, donde se descompone de forma parcial en oligosacáridos por las endo-ß-glucanasas bacterianas, seguido de la fermentación bacteriana de los oligosacáridos. Se sabe que la estructura molecular del XG posee propiedades mucomiméticas y mucoadhesivas. El XG a menudo se combina con gelatina o gelosa para prolongar su disponibilidad en el intestino, pero muestra efectos protectores similares al XG solo sobre la función de barrera en ratas después de infecciones por Salmonella enterica y Enterococcus hirae. La combinación de XG, proteínas de guisante, taninos de xilooligosacáridos de uva también ofreció protección contra la hipersensibilidad visceral inducida por estrés y la hiperpermeabilidad intestinal en ratas.
En humanos, varios ensayos clínicos demostraron la eficacia del XG en el tratamiento de la diarrea aguda en niños y adultos, y también en la diarrea crónica en pacientes con SII, al mejorar la mayoría de los síntomas. Hasta ahora, estos hallazgos no se relacionan con su capacidad para regular la BEI, y se necesitan ensayos adicionales para respaldar este concepto.
Tanato de gelatina
El tanato de gelatina (TG) es un complejo de ácido tánico y gelatina que forma enlaces electrostáticos con la mucina para crear una biopelícula a base de proteínas sobre la mucosa intestinal. La gelatina es un derivado del colágeno, que se ingiere como un polvo insoluble a pH ácido, que se convierte en gelatina a pH > 5.5. En el intestino, este complejo aumenta la resistencia epitelial contra E. coli, y contribuye a restaurar la fisiología normal de la función de barrera en las células Caco y Goblet. El TG también ayuda a restaurar la capa mucosa y a modular la microbiota intestinal en el modelo de colitis múrida SSD, y en las células Caco-2, donde previene la liberación de TNF-α inducida por LPS. Además, los taninos permiten la precipitación de moléculas proinflamatorias del moco intestinal y su eliminación fecal. Juntas, estas observaciones pueden explicar el efecto protector del TG sobre la función de la barrera intestinal.
Se realizaron varios ensayos clínicos con TG para la diarrea aguda en niños y adultos, con resultados mixtos. Se afirma que la combinación de TG y probióticos tindalizados es muy eficaz en el tratamiento de la diarrea moderada y prolongada, pero la evidencia clínica aguarda los resultados de un ensayo clínico en curso (ISRCTN63068134). Al igual que el XG, se necesitan pruebas adicionales para vincular los efectos positivos con el efecto protector sobre la BEI.
Diosmectita
La diosmectita es una arcilla medicinal (silicato de aluminio y magnesio) que se utiliza con frecuencia como terapia adyuvante en niños y adultos con diarrea aguda, para reducir la producción de heces, proporcionar alivio sintomático y prevenir la deshidratación. El mecanismo de acción es complejo, pero en parte se relaciona con modificaciones de las características reológicas de la barrera mucosa gastrointestinal, para reducir la penetración de toxinas, propiedades adsortivas, reducción de la permeabilidad intestinal al aumentar la expresión de OCLN, CLDN-1 y ZO-1. y aumento de la expresión de MUC2. Estos mecanismos se replicaron de manera principal en líneas celulares Caco-2 y HT-29, y en modelos animales de roedores y lechones en respuesta a TNF, ácido acético o TNBS.
Se demostró que la diosmectita mejora la diarrea aguda y crónica, según una serie de ensayos clínicos abiertos, aleatorizados, doble ciego, controlados con placebo, realizados de forma principal en niños con diarrea aguda y destacados en una revisión Cochrane reciente. No obstante, el beneficio clínico no se asoció con sus características de la barrera protectora.
Epigenética y regulación de la función de barrera intestinal mediada por exosomas
En la última década, se reportó de manera amplia sobre la función de los exosomas (derivados de los alimentos y del huésped) y los microARN encerrados (miARN) como moduladores de las respuestas inmunitarias y la función de la BEI. Los miARN son ARN no codificantes pequeños (21-23 pb) que regulan la expresión génica, ya sea al unirse a la región 3' no traducida de sus ARNm diana o mediante la escisión endonucleolítica del ARNm, lo que promueve la represión postranscripcional e influye en la homeostasis intestinal. Los miARN se implicaron en varios mecanismos fisiológicos y fisiopatológicos gastrointestinales y se estudiaron en enfermedades intestinales inmunes e inflamatorias, como el SII y la EII, aunque los estudios son muy heterogéneos.
Tanto los ensayos in vitro como in vivo demostraron de manera reciente que después de la administración de IL-1β, tanto las células Caco-2 como los enterocitos de ratones con colitis muestran un aumento de la permeabilidad de la UE del intestino delgado, un aumento rápido de miR200C-3p y niveles reducidos de ARNm y proteína de OCLN, mientras tanto, el antagomiR-200c previno los cambios de OCLN y permeabilidad. Además, los tejidos del colon y los organoides de pacientes con CU tenían niveles aumentados de ARNm de IL-1β y miR200C-3p en comparación con los controles sanos. En otros estudios, la transfección de miR-21 en células Caco-2 también resultó en la pérdida de UE, así como en cambios ultraestructurales que mejoraron la permeabilidad intestinal por medio de la degradación de RhoB y PTEN. También se observó un aumento de miR-21 y miR-126 en el colon, las heces y la sangre de pacientes con CU y EC. Además, también se observa un aumento de la expresión de miR-122a en las células Caco-2 después de la exposición al TNF-α, lo que aumenta la permeabilidad de la barrera mediante la degradación del ARNm de OCLN.
Al inactivar la endonucleasa RNasa Dicer, enzima responsable de la escisión de los pre-miARN y la siguiente maduración a miARN funcionales, McKeena et al mostraron una expresión alterada de cadherina 1 y catepsina B. Los mutantes de Dicer1 también mostraron una función deteriorada de la barrera epitelial, es muy probable que debido a la desorganización de la capa epitelial y los complejos de unión. Por lo tanto, el papel de miR-144 en la disminución de la expresión de OCLN y ZO-1 y en la mejora de la permeabilidad intestinal se reportó en un modelo de rata de IBS-D.
Otros miARN, como miR-93 y miR-29a/b, parecen ofrecer efectos protectores sobre la función de barrera. El miARN-93 es responsable de la disminución de la expresión de PTK6 en las células YAMC, lo que revierte los efectos en la permeabilidad causados por TNF-α e IFN-γ. El miR-29a y el miR-29b previnieron la inflamación en ratones después de la colitis inducida por SSD cuando se administraron con nanopartículas de supercarbonato de apatita. También se encontraron niveles elevados de miR-29a en sangre, intestino delgado y colon en pacientes con SII y colon en pacientes con EII, pero, de hecho, su función es a veces contradictoria. La sobreexpresión de miR-29a aumentó la permeabilidad epitelial al dirigirse al gen de la glutamina sintetasa (GLUL), alteración que se asoció de forma previa con una mayor permeabilidad de la membrana. Además, en pacientes con SII-D, se describieron niveles aumentados de miARN-29a y miARN-29b junto con una reducción de CLDN1, ZO-1 y factor represor del factor nuclear-kB, mientras que también se observaron niveles aumentados en modelos de ratones de SII o colitis.
Después de mostrar una correlación entre la expresión diferencial de ARNm y los cambios ultraestructurales en el epitelio de pacientes con SII-D, el mismo grupo reportó la capacidad de miR-16 y miR-125b para modular la función de la barrera en el yeyuno de estos pacientes por medio de la regulación de la expresión de claudina-2 y cingulina, de manera respectiva. En un estudio reciente, Martínez et al reportaron sobre varios miRNAS regulados en la mucosa rectal de pacientes postinfecciosos con SII junto con la disminución de la expresión de sus ARNm diana involucrados en la función de barrera. Al final, Mahurkar-Joshi et al reportaron niveles reducidos de miR-219a-5p y miR-338-3p en biopsias sigmoides en SII, de manera particular en SII-C. La inhibición de miR-219a-5p resultó en una expresión alterada de genes de función de barrera/proteasoma y mejoró la permeabilidad de las células epiteliales intestinales. De manera adicional, la inhibición de miR-338-3p en las células provocó alteraciones en los genes de la vía de transmisión de señales de la proteína cinasa activada por mitógenos (PKAM).
No sólo los miARN del hospedador, sino también los miRNAS derivados de plantas y bacterias recibieron especial atención por su papel potencial, aunque discutido, como reguladores de la expresión génica entre reinos, que influyen en las interacciones de las plantas con animales y microorganismos para regular una serie de funciones fisiológicas. En los seres humanos, la dieta sería una fuente primaria de absorción de miRNA de plantas, por lo que se denominaron como xeno-miRNAs (xenomiRs), además, detección y cuantificación eficaz de microRNA de plantas absorbido mediante la dieta en el plasma humano. Se proponen varios mecanismos, incluidos los portadores de miARN transmembrana, la endocitosis, la fagocitosis, la macropinocitosis, la endocitosis mediada por clatrina, mediada por caveolina e independiente de clatrina y caveolina, la difusión paracelular y la captura de células inmunitarias luminales para explicar la captación de xenomiRs por células epiteliales intestinales, aunque, hasta la fecha, aún no se resuelven. Más tarde, los xenomiRs podrían empaquetarse en microvesículas o asociarse con complejos resistentes a proteinasa K para ser transportados y liberados al torrente sanguíneo para alcanzar los tejidos diana. Se demostró que la absorción de xenomiR más estables, como miR-2911, podría promoverse cuando se mejora la permeabilidad intestinal, lo que puede ser útil para la administración de miARN dietético. Además, la microbiota intestinal podría ser responsable de mejorar la absorción de xenomiR, y aumentar su biodisponibilidad al degradar los componentes de los exosomas.
A pesar del conocido papel de los xenomiR en la formación de la microbiota y en la modulación de la inflamación y la activación inmunitaria, incluida la disminución de la expresión del receptor de TNF, no se reportó de la regulación directa de la barrera epitelial. Sin embargo, dada la capacidad del TNF-α para modular la permeabilidad de la barrera, los xenomiRs podrían participar de forma indirecta en la regulación de la BEI. Además, varios estudios demostraron la capacidad de los exosomas derivados de plantas, enriquecidos con diversos miARN, para contribuir a la integridad de la barrera intestinal, aunque, otra vez, no se pudo establecer un vínculo directo y el efecto sobre la función de la barrera podría depender de otros mecanismos no relacionados con xenomiR. Debido a que algunos xenomiR de plantas modulan la expresión de transportadores de enterocitos, citocinas involucradas en la función de barrera como TNF-α o IL-1β, y la activación de la vía Wnt/β-catenina, aún es pausible que los xenomiR puedan actuar como reguladores de la permeabilidad de la barrera intestinal. Además, la microbiota intestinal, al mejorar la absorción de xenomiR, también puede regular la expresión de diferentes miARN en CEI.
Por lo tanto, al considerar el papel prometedor de los miARN en la modulación de la función de barrera intestinal, las estrategias terapéuticas basadas en miARN se mueven del banco a la cama. Aunque con varias limitaciones, la regulación de la expresión de miARN se puede lograr mediante la administración de miARN sintéticos o miARN que expresan vectores o mediante nucleótidos antisentido. Su aplicación terapéutica para la función de barrera y la inflamación intestinal y el cáncer está en desarrollo, aunque se necesitan más investigaciones.
RESUMEN Y CONCLUSIONES
Éste es un momento emocionante para la permeabilidad intestinal. Se pasó de no reconocer la importancia de la permeabilidad intestinal, hace no más de 30 años, a expresar ahora que la mayoría de los trastornos digestivos y extradigestivos tienen algo que ver con ella.
De manera probable, la verdad se encuentra en algún lugar entre estos dos extremos. Lo cierto es que el conocimiento fisiopatológico, funcional y molecular avanzó mucho en ese lapso, y con él, la búsqueda de mejores opciones terapéuticas para el manejo de los trastornos de la permeabilidad intestinal. En esta revisión, se discutieron los enfoques terapéuticos más relevantes para mejorar la permeabilidad intestinal y la disfunción de la barrera. Para avanzar se necesitan más ensayos clínicos, nuevas moléculas destinadas de forma directa a la puesta a punto de la permeabilidad intestinal, tratamientos diferenciales según el segmento intestinal afectado, según el sexo, según la edad y muchas otras variantes. Además, es importante reconocer el papel de otros factores, como la activación inmune y la regulación de los defectos de la barrera relacionada con la microbiota, para tratar mejor la inflamación crónica en el tracto gastrointestinal porque apuntar sólo a la barrera puede no ser suficiente para cambiar la historia natural de muchas de estas condiciones. El avance en el conocimiento de los mecanismos íntimos y los factores inductores y predictores de cambios en la permeabilidad conducirá al desarrollo de un mejor abordaje terapéutico en diversas enfermedades digestivas y también extradigestivas.
REVIEW article
Front. Nutr., 28 October 2021 | https://doi.org/10.3389/fnut.2021.718093
Present and Future Therapeutic Approaches to Barrier Dysfunction
Marina Fortea1†‡, Mercé Albert-Bayo2†‡, Mar Abril-Gil2‡, John-Peter Ganda Mall2,3‡, Xavier Serra-Ruiz4‡, Alejandro Henao-Paez4‡, Elba Expósito2‡, Ana María González-Castro2‡, Danila Guagnozzi2,4,5,6‡, Beatriz Lobo2,4,5‡, Carmen Alonso-Cotoner2,4,5,6*‡ and Javier Santos2,4,5,6‡
Centro Regional de Alergia e Inmunología Clínica CRAIC, Hospital Universitario “Dr. José Eleuterio González” UANL, Monterrey, México
Dra. Med. Sandra Nora González Díaz Jefe y Profesor
Dra. Rosalaura Virginia Villarreal González Profesor
Dra. Daniela Robles Rodríguez Residente 2° Año
Dra. Alejandra Macías Weinmann Profesor
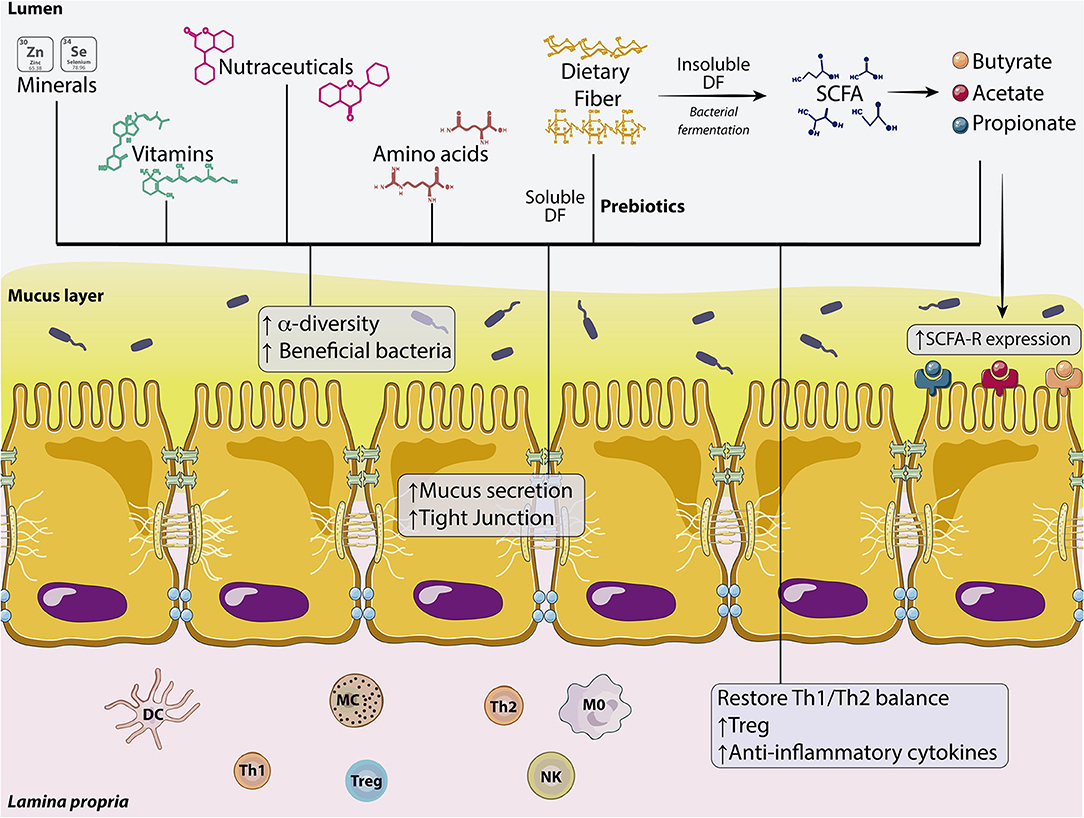
%2010.40.20.png)
No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.