
Actualización de la información publicada el 28 de agosto de 2020.
| Índice 1. Contenido, interpretación y presentación de los datos 2. Casos de sospechas de reacciones adversas notificados en España con tratamientos para COVID-19 3. Hallazgos más relevantes a. Arritmias cardíacas b. Trastornos psiquiátricos c. Trastornos hepáticos d. Trastornos hematológicos e. Trastornos renales f. Perforaciones intestinales g. Síndrome Serotoninérgico 4. Recomendaciones para la notificación de sospechas de reacciones adversas a medicamentos para el tratamiento de la COVID-19 5. Autores 6. Bibliografía 1. Contenido, interpretación y presentación de los datos El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), está realizando un seguimiento estrecho de las sospechas de reacciones adversas notificadas con fármacos considerados estrategias terapéuticas potenciales para la infección de SARS-CoV-21. Los medicamentos que se están revisando son los siguientes: remdesivir, lopinavir/ ritonavir, hidroxicloroquina, cloroquina, tocilizumab, sarilumab, ruxolitinib, siltuximab, baricitinib, anakinra, interferón beta-1B e interferón alfa-2B. La base de datos de sospechas de reacciones adversas, denominada FEDRA, recoge todos los casos que los profesionales sanitarios o la ciudadanía notifican en España, bien sea a través de su centro autonómico de farmacovigilancia, o a través de la industria farmacéutica. FEDRA no recoge casos procedentes de ensayos clínicos. El principal objetivo de la notificación de sospechas de reacciones adversas a medicamentos (RAM) es el de servir como sistema ágil y rápido de identificación de posibles reacciones adversas no identificadas previamente, o cambios en la forma de presentación de reacciones adversas ya conocidas. En la actualidad el único medicamento autorizado indicado para la COVID-19 es el remdesivir. Se están empleando medicamentos autorizados en otras indicaciones, algunos de ellos con pautas de administración diferentes a las autorizadas (ej. hidroxicloroquina). Adicionalmente las características basales de los pacientes con COVID-19 difieren de las de aquellos otros que utilizan estos fármacos en sus indicaciones autorizadas, pudiendo afectar también al perfil de reacciones adversas de estos fármacos en dichos pacientes. En esta situación, la información de seguridad disponible es muy escasa, siendo de gran importancia generar de manera precoz información sobre la seguridad de estos tratamientos.
Hasta el 26 de julio de 2020 se han registrado en FEDRA un total de 327 casos de sospechas de reacciones adversas en pacientes con COVID-19 tratados con los fármacos objeto de seguimiento. De los 327 casos, 284 (87%) han sido notificados directamente a los Centros Autonómicos de Farmacovigilancia y el 13% restante a través de la industria farmacéutica. La mayoría han sido comunicados por profesionales sanitarios (316 casos, 97%) y 38 casos (12%) proceden de estudios. De los 327 casos, 137 proceden de un hospital con un sistema de farmacovigilancia activa que revisa resultados analíticos para detectar posibles reacciones adversas, lo que explica que algunas reacciones adversas estén sobrerrepresentadas como ocurre en los trastornos hepáticos. La mayoría de los pacientes eran adultos (60%) o mayores de 65 años (36%). El 69% de los casos corresponden a varones. Generalmente los pacientes con COVID-19 reciben combinaciones de varios medicamentos y se pueden considerar sospechosos de haber producido la reacción adversa a todos ellos, sólo a algunos o incluso a otros medicamentos que el paciente estuviera tomando. En algunas ocasiones las reacciones adversas se producen debido a la interacción de varios medicamentos que el paciente está recibiendo; por ejemplo, la administración de lopinavir/ritonavir inhibe la isoforma CYP3A del citocromo P450, por lo que no debería administrarse junto con medicamentos cuyo aclaramiento dependa en gran medida del CYP3A y para los que un aumento de las concentraciones plasmáticas se asocie con reacciones adversas graves. De los casos notificados, hidroxicloroquina aparece registrado como medicamento sospechoso en 250 casos, lopinavir/ritonavir en 141, tocilizumab en 76, interferón beta 1B en 12, remdesivir en 13, cloroquina en 5, anakinra en 3 y baricitinib en 1 caso. No se han recibido notificaciones con interferón alfa 2B, ruxolitinib, sarilumab ni siltuximab. Cabe esperar que los fármacos que más se administran sean los más notificados por lo que un mayor número de casos notificados no es indicativo de mayor riesgo. La tabla 1 muestra la distribución de los casos para los medicamentos en seguimiento en los que constaba COVID-19 como indicación terapéutica, incluyendo sus combinaciones más frecuentes. Además de estos medicamentos en seguimiento, esta tabla incluye la azitromicina dado que se ha empleado frecuentemente junto con la hidroxicloroquina. Cabe destacar que también otros fármacos que tomaba el paciente se han considerado en algunos casos sospechosos de haber producido la reacción; estos no se incluyen en la tabla y los más frecuentes han sido ceftriaxona (76 casos), enoxaparina (20 casos), levofloxacino (11 casos) y paracetamol (8 casos).  De los 327 casos registrados en este periodo, 298 son graves* (91%), ya que la notificación de los mismos es prioritaria frente a los casos menos graves. En la figura 1 se muestra la distribución de todas las sospechas de reacciones adversas agrupadas por órgano o sistema incluidas en las notificaciones para cada uno de los fármacos en seguimiento cuando se han utilizado para el tratamiento de la COVID-19. Hay que tener en cuenta que una notificación puede incluir más de una sospecha de reacción adversa. 
Se han comunicado 54 casos de arritmias cardíacas que incluyen 64 términos de sospechas de reacciones adversas: Síndrome QT largo (30), fibrilación auricular (7), bradicardia (5), muerte súbita (4), taquicardia (4), parada cardiorrespiratoria (3), aleteo auricular (2), bradicardia sinusal (2), arritmia supraventricular (1), bloqueo auriculoventricular de primer grado (1), bloqueo de rama derecha (1), extrasístoles (1), taquiarritmia (1), taquicardia sinusal (1), taquicardia ventricular (1) (ver Figura 2). 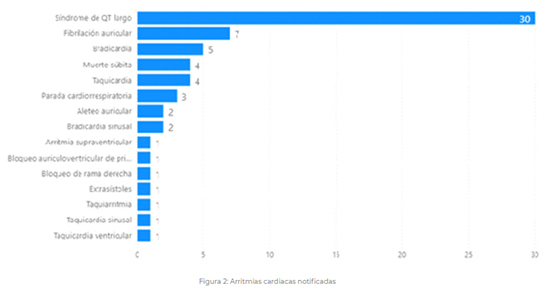 En 10 de los 54 casos el paciente falleció (4 de ellos de muerte súbita). Dieciocho pacientes se habían recuperado en el momento de la notificación, 5 estaban en recuperación, 1 no se había recuperado y en 17 casos se desconoce el desenlace. Treinta y seis casos correspondieron a varones. El rango de edad de los pacientes con arritmia fue de 38 a 95 años, excepto un recién nacido. En 22 casos hay información sobre los antecedentes cardíacos de los pacientes: cardiopatía isquémica (3), miocardiopatía hipertensiva (1), fibrilación auricular (1), QT largo (1), hipertensión arterial (14), sin antecedentes (3). De los 54 casos, en 48 se sospechó de hidroxicloroquina, 33 en combinación con azitromicina y 33 en combinación con lopinavir/ritonavir. En ambos casos puede existir una interacción, con azitromicina de tipo farmacocidinámico y con lopinavir/ritonavir de tipo farmacocinético, que puede aumentar el riesgo de prolongar el intervalo QT. El tiempo entre el inicio del tratamiento con hidroxicloroquina y la aparición de la arritmia estaba comprendido entre 1 y 55 días. Por otra parte, 10 pacientes recibían otros fármacos con actividad arritmogénica conocida. El 22 de abril, la AEMPS publicó una nota informativa MUH (FV), 7/2020 sobre cloroquina e hidroxicloroquina advirtiendo sobre el riesgo de aparición de trastornos del ritmo2.
Durante el periodo de seguimiento se han notificado 19 casos que incluyen 30 términos de sospechas de reacciones adversas psiquiátricas (ver Figura 3). 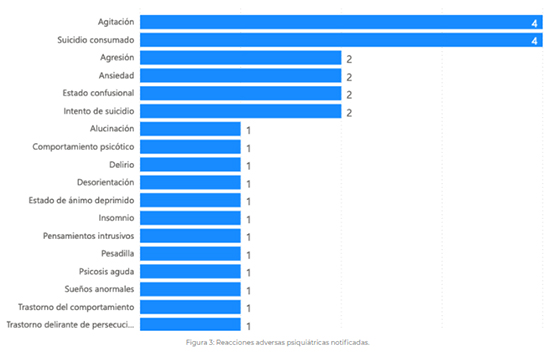 En 17 casos la reacción adversa fue grave, 15 de ellos en pacientes que recibieron tratamiento con hidroxicloroquina. Los otros casos graves restantes fueron un estado confusional con agitación asociado a interferón beta 1B, darunavir/cobicistat, azitromicina y ceftriaxona; y un delirio en contezto de un síndrome serotoninérgico con lopinavir/ritonavir, litio y duloxetina. Los dos casos no graves corresponden a un caso de insomnio y otro de ansiedad, ambos en pacientes tratados con lopinavir/ritonavir. Descripción de los casos psiquiátricos con hidroxicloroquina: Se han recibido 15 notificaciones, todas graves, que incluyen las siguientes sospechas de reacciones adversas: suicidios consumados (4), intento de suicidio con psicosis aguda o pensamientos intrusivos (2), agitación (3), trastorno delirante (1), comportamiento psicótico (1), alteración de conducta con agresividad (2), ansiedad con sueños anormales, pesadillas y acatisia (1), alucinaciones (1), estado confusional (1), y psicosis afectiva con manía. En 5 casos el desenlace fue mortal, 7 pacientes se recuperaron tras la retirada de la hidroxicloroquina, 2 no se había recuperado en el momento de la notificación y en 1 se desconoce el desenlace. La mayoría eran varones (12 casos), de edades comprendidas entre los 26 y los 86 años. Las reacciones adversas aparecieron mayoritariamente entre 2 y 5 días tras el inicio del tratamiento. De los 15 pacientes, 10 no referían antecedentes psiquiátricos, en 4 se desconoce y en otro se trata de un paciente con discapacidad intelectual y una dudosa alteración conductual previa. En 8 de los 15 casos el único medicamento considerado sospechoso de haber producido la reacción es la hidroxicloroquina. En algunos casos los pacientes recibían tratamiento concomitante con medicamentos relacionados con ideación suicida u otros trastornos psiquiátricos. El 14 de mayo, la AEMPS actualizó la nota informativa MUH (FV), 7/2020 sobre cloroquina e hidroxicloroquina advirtiendo del riesgo de aparición de trastornos neuropsiquiátricos graves3.
Se han notificado 134 casos de trastornos hepáticos con medicamentos utilizados en COVID-19 que describen 146 términos de sospechas de reacciones adversas, en las que interviene mayoritariamente hidroxicloroquina como sospechoso (117 casos), seguida de lopinavir/ritonavir (44 casos) y tocilizumab (43 casos), si bien en la mayoría los pacientes reciben otros fármacos que también se han relacionado con trastornos hepáticos, siendo el más representado la azitromicina (87). La hepatitis es la reacción adversa más frecuente (84 hepatitis, 11 hepatitis agudas, 4 hepatitis colestáticas, y 1 hepatitis tóxica) seguida de hiperbilirrubinemias (18) e hipertransaminasemias (16) (ver Figura 4). En el 97% de los pacientes (130 casos) se consideró que las sospechas de reacciones adversas eran graves.  El rango de edad de los pacientes fue de 9 a 89 años, la mayoría eran adultos (73%) y 105 pacientes eran varones (78%). Las reacciones aparecieron entre 1 y 30 días tras el inicio del tratamiento. En 33 de los 134 casos el paciente se recuperó, 64 estaban recuperándose, 7 no se habían recuperado, un paciente falleció y en el resto el desenlace era desconocido. En 19 casos se registró también empeoramiento de la enfermedad, por haberse observado analíticas previas en las que la función hepática ya estaba alterada. La mayoría de estos casos (95; 71%) proceden de un único hospital que tiene implantado un sistema de farmacovigilancia activa que revisa resultados analíticos para detectar posibles reacciones adversas, lo que explica que los trastornos hepáticos estén sobre representados con respecto al total de notificaciones recibidas. Se han descrito alteraciones hepáticas asociadas a la propia infección por COVID-194,5. Las fichas técnicas6 de medicamentos que se han administrado a estos pacientes como hidroxicloroquina, lopinavir/ritonavir, interferón beta-1B, azitromicina, ceftriaxona, amoxicilina clavulánico y tocilizumab recogen alteraciones de la función hepática, incluyendo la mayoría de ellas hepatitis o fallo hepático agudo. El material sobre prevención de riesgos de tocilizumab advierte de que se han observado casos graves de daño hepático en pacientes en tratamiento7. d. Trastornos hematológicos Se han comunicado 41 casos que describen 51 términos de sospechas de reacciones adversas (ver Figura 5).  La mayoría de estos casos (76%) proceden de un único hospital que tiene implantado un sistema de farmacovigilancia activa que revisa resultados analíticos de los pacientes para detectar posibles reacciones adversas. Las reacciones adversas ocurrieron entre 1 y 55 días tras el inicio del tratamiento. Todos los casos excepto tres, fueron graves (38; 93%). Cuatro de los pacientes fallecieron, 9 no se habían recuperado, 11 estaban en recuperación, 14 se recuperaron en el momento de la notificación; en los 3 casos restantes se desconocía esta información. El rango de edad de los pacientes fue de 21 a 81 años. De los 41 casos, 26 pacientes (63%) eran varones. De las sospechas de reacciones adversas hematológicas notificadas, cabe destacar las siguientes: Diecisiete casos de hipofibrinogenemia; en todos los casos constaba la administración de tocilizumab, siendo en 10 el único fármaco sospechoso. En 7 de los casos se había administrado también hidroxicloroquina. La hipofibrinogenemia es una reacción adversa conocida para tocilizumab de aparición frecuente. Cinco casos de trombocitopenias y 1 de trombocitopenia inmune. En 5 de ellos el paciente estaba en tratamiento con hidroxicloroquina, siendo la trombocitopenia una reacción adversa conocida para este fármaco. Cinco casos de neutropenia, 3 en pacientes que recibían hidroxicloroquina, 1 en un paciente que recibía tocilizumab y otro en un paciente que recibía ambos fármacos. Para la hidroxicloroquina está descrita la posibilidad de aparición de leucopenia y para tocilizumab la de neutropenia. En 4 de los casos se retiró el tratamiento, encontrándose el paciente en recuperación en el momento de la notificación. Cinco casos de disminución de la coagulabilidad y 2 de coagulopatía, figurando en 5 de ellos tocilizumab como fármaco sospechoso de haber producido estos cuadros. Como se ha comentado, la hipofibrinogenemia es una reacción adversa conocida para tocilizumab, condición que puede afectar a la coagulabilidad. Adicionalmente, se han notificado 6 casos de anemia, 2 de anemia hemolítica y 1 de anemia junto a hemorragia gastrointestinal. En cuatro de los casos se incluye como fármacos sospechosos tanto tocilizumab como hidroxicloroquina, en dos casos solo consta la administración de hidroxicloroquina, en uno solo consta tocilizumab y en otro remdesivir. En ninguno de los 2 casos notificados de anemia hemolítica figura si los pacientes presentaban déficit de glucosa-6-fosfato-deshidrogenasa. e. Trastornos renales Se han notificado 19 casos de trastornos renales que incluyen 19 términos de reacción adversa, entre ellas: lesión renal aguda (9), fracaso renal (3), anuria (2), retención urinaria (2), nefropatía tóxica (1), cólico renal (1) y deterioro renal (1) (ver figura 6). Todas ellas se consideraron graves.  Las reacciones adversas renales aparecieron entre 1 y 20 días del comienzo del tratamiento considerado sospechoso. Tres de los pacientes fallecieron, 9 se recuperaron, 3 pacientes no se habían recuperado y uno estaba en recuperación en el momento de la notificación, en los 4 casos restantes el desenlace era desconocido. El rango de edad de los pacientes fue de 21 a 82 años, siendo 15 varones (79%) y 5 mujeres. El 60% de los pacientes eran mayores de 65 años. Cuatro de los pacientes tenían antecedentes de trastornos renales. El fármaco más frecuentemente implicado como sospechoso fue lopinavir/ritonavir (15), seguido de hidroxicloroquina (11), tocilizumab (2), anakinra (1), remdesivir (1) y baricitinib (1), si bien en la mayoría de los casos aparecen combinaciones entre ellos y con otros fármacos nefrotóxicos. La insuficiencia renal está descrita en la ficha técnica de lopinavir/ritonavir, en dos de los pacientes el tratamiento fue administrado por sonda nasogástrica y se ha considerado también sospechoso el propilenglicol de la solución oral. Seis de los pacientes recibieron azitromicina y 4 ceftriaxona; ambos medicamentos pueden contribuir a la aparición de efectos renales como nefritis intersticial e insuficiencia renal aguda. Además, un paciente recibía anfotericina B que administrado simultáneamente con otros fármacos nefrotóxicos puede aumentar el potencial de toxicidad renal inducida por medicamentos. Otros fármacos que se han administrado en algunos pacientes como ciclosporina, tacrolimus, linezolid, ertapenem, metformina, quinolonas, diuréticos, IECA, ARAII e IBP, pueden contribuir también a la aparición de esta reacción adversa. La nefrotoxicidad inducida por medicamentos es una causa muy común de lesión aguda del riñón, especialmente en pacientes de riesgo (de edad avanzada, con insuficiencia renal basal, deshidratación, diabetes, o exposición a más de un fármaco nefrotóxico). Se ha recibido, un caso de fracaso renal e hipotensión con remdesivir como fármaco sospechoso; aunque aún no está bien caracterizado el perfil de seguridad de remdesivir, los trastornos renales se han considerado como eventos de especial interés para este fármaco. También se registra un caso de lesión renal aguda en un paciente que recibía baricitinib, cuyo desenlace fue mortal; se trata de una reacción adversa no descrita en la ficha técnica de este medicamento. f. Perforaciones intestinales Se han notificado 6 casos de perforaciones intestinales en los que se ha considerado tocilizumab como único fármaco sospechoso, excepto en uno de ellos, en el que también se ha considerado sospechosa la metilprednisolona y en otro la enoxaparina. Las perforaciones intestinales aparecieron entre los 7 y los 30 días tras la administración de tocilizumab. Dos de los pacientes fallecieron, dos estaban en recuperación en el momento de la notificación, uno se recuperó y en el caso restante el desenlace era desconocido. El rango de edad de los pacientes fue de 52 a 67 años, siendo el 83% varones. Se desconoce si alguno de los pacientes tenía antecedentes gastrointestinales. No obstante, en tres de los casos hay indicios de isquemia mesentérica. Pacientes graves con COVID-19 pueden tener alteraciones hemodinámicas, lo que puede conducir a una hipoperfusión intestinal que puede comprometer la integridad de la mucosa intestinal. La ficha técnica de tocilizumab describe perforaciones intestinales a partir de datos de ensayos clínicos, con una tasa global de perforaciones intestinales que oscila entre 0,26 -0,28 acontecimientos por 100 pacientes-años en tratamiento. Estas reacciones fueron comunicadas inicialmente como complicaciones de diverticulitis, tales como peritonitis purulenta generalizada, perforación gastrointestinal inferior, fístulas y abscesos. Se ha descrito que la perforación intestinal asociada a tocilizumab podría no acompañarse de una elevación de la proteína-C-reactiva y pasar desapercibida inicialmente en pacientes sedados y ventilados8. g. Síndrome Serotoninérgico Se han comunicado dos casos de síndrome serotoninérgico en pacientes COVID-19 tratados con lopinavir/ritonavir junto con medicamentos con potencial de producir síndrome serotoninérgico, probablemente por interacción farmacocinética entre lopinavir/ritonavir y estos medicamentos. El primer paciente estaba en tratamiento con litio y duloxetina, además de lopinavir/ritonavir e hidroxicloroquina. Al tercer día desarrolló delirio que fue tratado con haloperidol. En los siguientes 4 días su nivel de conciencia fue empeorando y debido a la sospecha de síndrome serotoninérgico se suspendieron duloxetina, litio, haloperidol y lopinavir/ritonavir con mejoría de su estado neurológico. El segundo caso fue tratado con lopinavir/ritonavir, hidroxicloroquina, interferón beta-1B y tocilizumab. Al décimo día, el paciente desarrolló delirio que fue tratado con risperidona y recibió una dosis única de morfina para control de la disnea. En los días posteriores el paciente empeoró su nivel de conciencia. Debido a la sospecha de síndrome serotoninérgico se suspendieron risperidona y lopinavir/ritonavir con mejoría rápida en los días posteriores. La risperidona se metaboliza por CYP2D6 y, en menor medida, por CYP3A4. Lopinavir/ritonavir puede aumentar potencialmente la exposición a risperidona y puede ser necesaria una disminución de la dosis9. El síndrome serotoninérgico, que puede ser mortal, se desencadena con el uso concomitante de agentes serotoninérgicos, entre los que se incluyen los inhibidores selectivos de la recaptación de serotonina (ISRS), los inhibidores de la recaptación de serotonina/noradrenalina (IRSN), los antidepresivos tricíclicos y los triptanos, junto con la administración de agentes que afectan al metabolismo de la serotonina, o con antipsicóticos u otros antagonistas dopaminérgicos, que también pueden afectar a la neurotransmisión serotoninérgica. Lopinavir/ritonavir presenta numerosas interacciones farmacocinéticas con medicamentos antipsicóticos y antidepresivos, por lo que podría desencadenar un síndrome serotoninérgico en pacientes en tratamiento concomitante con estos medicamentos, debido a una eliminación disminuida de los mismos10. Por ello, es recomendable un ajuste de dosis cuando se usan conjuntamente. 4. Recomendaciones para la notificación de sospechas de reacciones adversas a medicamentos para el tratamiento de la COVID-19 Se anima a los profesionales sanitarios y a la ciudadanía a notificar las sospechas de reacciones adversas relacionadas con tratamientos utilizados en COVID-19. Para ello, recomendamos el uso del formulario www.notificaRAM.es, así como cualquier otro medio puesto a disposición por su Centro Autonómico de Farmacovigilancia. Para ayudar a interpretar correctamente las notificaciones, es importante reflejar correctamente la siguiente información: · Edad y sexo del paciente. · Nombre del medicamento, dosis y duración e indicación terapéutica, reflejando si se trata de tratamiento o profilaxis. Para los medicamentos biológicos, indicar el número de lote. Además de los medicamentos que se consideran sospechosos de haber ocasionado la reacción adversa, es conveniente incluir otros medicamentos que pudiera estar tomando el paciente en el mismo periodo. · Antecedentes clínicos relevantes y estado del paciente debido al COVID-19 en el momento de la reacción adversa (ingresado en UCI, ingresado en planta, paciente ambulatorio). · Descripción de la reacción adversa con fecha de inicio y finalización, así como el desenlace de la misma en el momento de la notificación. 5. Autores Grupo de Trabajo del CTSEFV-H para el seguimiento casos de sospechas de RAM notificados en tratamientos para infección por SARS-CoV-2 (Ponente Montserrat García, coponente Edurne Lázaro). · Centro Autonómico de Farmacovigilancia de Andalucía (Nieves Merino, Carmen María Jiménez, Asunción Mengíbar y Mercedes Ruiz). · Centro Autonómico de Farmacovigilancia de Canarias (Marcelino García, Eduardo Fernández) · Centro Autonómico de Farmacovigilancia de Cataluña (Gloria Cereza) · Centro Autonómico de Farmacovigilancia de Comunidad Valenciana (Juan José Carreras) · Centro Autonómico de Farmacovigilancia de Extremadura (Eva Trejo) · Centro Autonómico de Farmacovigilancia de Murcia (María José Peñalver) · Centro Autonómico de Farmacovigilancia de Navarra (Gabriela Elizondo) · Centro Autonómico de Farmacovigilancia de País Vasco (Montserrat García y Carmelo Aguirre) · División de Farmacoepidemiología y Farmacovigilancia de la Agencia Española de Medicamentos y Productos Sanitarios (Lara Quiroga, Carmen Quiroga, Mar Gutiérrez, Araceli Núñez, Cristina Fernández y Edurne Lázaro). 6. Bibliografía 1 Tratamientos disponibles sujetos a condiciones especiales de acceso para el manejo de la infección respiratoria por SARS-CoV-2, (actualizado a 28 de mayo de 2020) https://www.aemps.gob.es/la-ae... 2 Nota Informativa de Seguridad de la AEMPS: MUH (FV), 7/2020 actualización 14 de mayo: Cloroquina/Hidroxicloroquina: precauciones y vigilancia de posibles reacciones adversas en pacientes con COVID-19 3 Nota Informativa de Seguridad de la AEMPS: MUH (FV), 7/2020 actualización 14 de mayo: Cloroquina/Hidroxicloroquina: precauciones y vigilancia de psoibles reacciones adversas en pacientes con COVID-19 4 Chao Zhang, Lei Shi, Fu-Sheng Wang. Liver injury in COVID-19: management and challenges. www.thelancet.com/gastrohep Vol 5 May 2020. Published Online March 4, 2020 https://doi.org/10.1016/S2468-... 5 Ling Xu, Jia Liu, Mengji Lu, Dongliang Yang, Xin Zheng. Liver injury during highly pathogenic human coronavirus infections. Liver International. 2020; 00: 1–7. 6 CIMA (Centro de Información de Medicamentos de la AEMPS): https://cima.aemps.es/cima/pub... 7 INFORMACIÓN IMPORTANTE DE SEGURIDAD DIRIGIDA A LOS PROFESIONALES SANITARIOS. Disponible en: https://cima.aemps.es/cima/Doc... 8 Vikse J, Henry BM. Tocilizumab in COVID-19: Beware the risk of intestinal perforation. Int J Antimicrob Agents [Internet]. 7 de mayo de 2020; Disponible en: https://www.ncbi.nlm.nih.gov/p... 9 University of Liverpool, Detailed recommendations for interactions with experimental COVID-19 therapies, Publishing Liverpool Drug Interaction Group, 2020, https://www.covid19-drugintera... 10 K.E. DeSilva, D.B. Le Flore, B.J. Marston, D. Rimland, Serotonin syndrome in HIV infected individuals receiving antiretroviral therapy and fluoxetine, AIDS 6 15 (10) (2001) 1281 |
| Enlaces de Interés | ||||||||||
| ||||||||||




No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.