Autor: Kerry-Ann F O’Grady, Keith Grimwood, Paul J Torzillo y colaboradores Lancet Child Adolesc Health 2019; 3: 889–98
| Introducción |
Hay pocos datos para validar el umbral de diagnóstico utilizado para definir a la tos crónica según su duración. Las guías internacionales definen a la tos crónica como una tos diaria durante al menos 4 semanas,8 y según las guías británicas por al menos 8 semanas.9
El diagnóstico precoz de trastornos pulmonares subyacentes en niños con tos crónica (ej., asma, cuerpo extraño inhalado, bronquiectasia) mejora los resultados clínicos. Para el conocimiento de los autores, ningún ECA ha evaluado un algoritmo de manejo de la tos crónica en su fase temprana en niños.
Por lo tanto, el objetivo principal fue determinar si la implementación de un algoritmo de manejo de la tos basado en evidencia10 en fases tempranas de la tos crónica en niños atendidos en clínicas no especializadas mejoraría la proporción de niños con resolución de la tos en comparación con la atención estándar. El objetivo secundario fue identificar predictores independientes de éxito o fracaso de la intervención.
| Métodos |
Los pacientes fueron excluidos por condición médica crónica subyacente (incluyendo trastornos pulmonares, pero no asma), enfermedad inmunosupresora, consumo de medicamentos inmunomoduladores por más de 2 semanas en los 30 días previos, síntomas severos que requirieran hospitalización, participación actual o planificada en otro estudio, o falta de dominio del inglés como para completar los requisitos del estudio.
La aleatorización se estratificó por motivo de presentación (enfermedad respiratoria aguda con tos o consulta por otra razón con enfermedad respiratoria aguda con tos notada incidentalmente), sitio de estudio y duración total de la tos al día 28 de enrolamiento (4 semanas a < 6 semanas o ≥ 6 semanas).
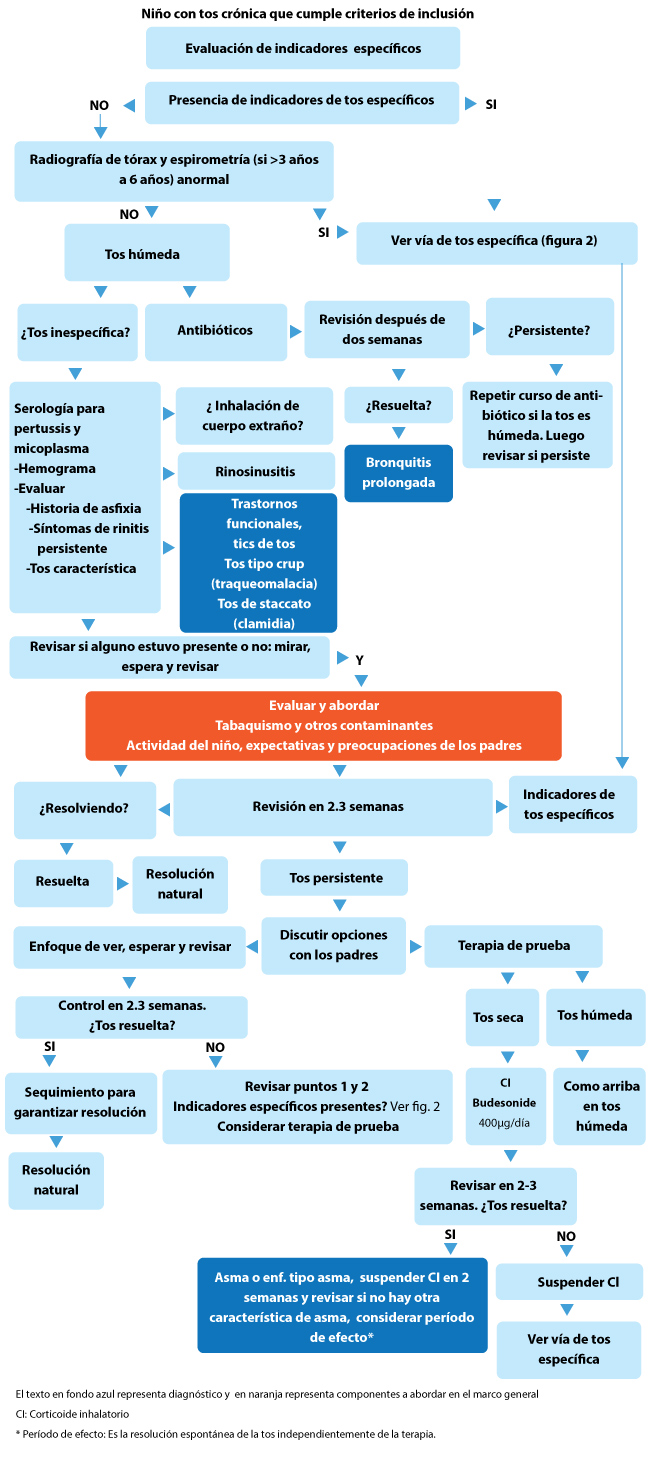
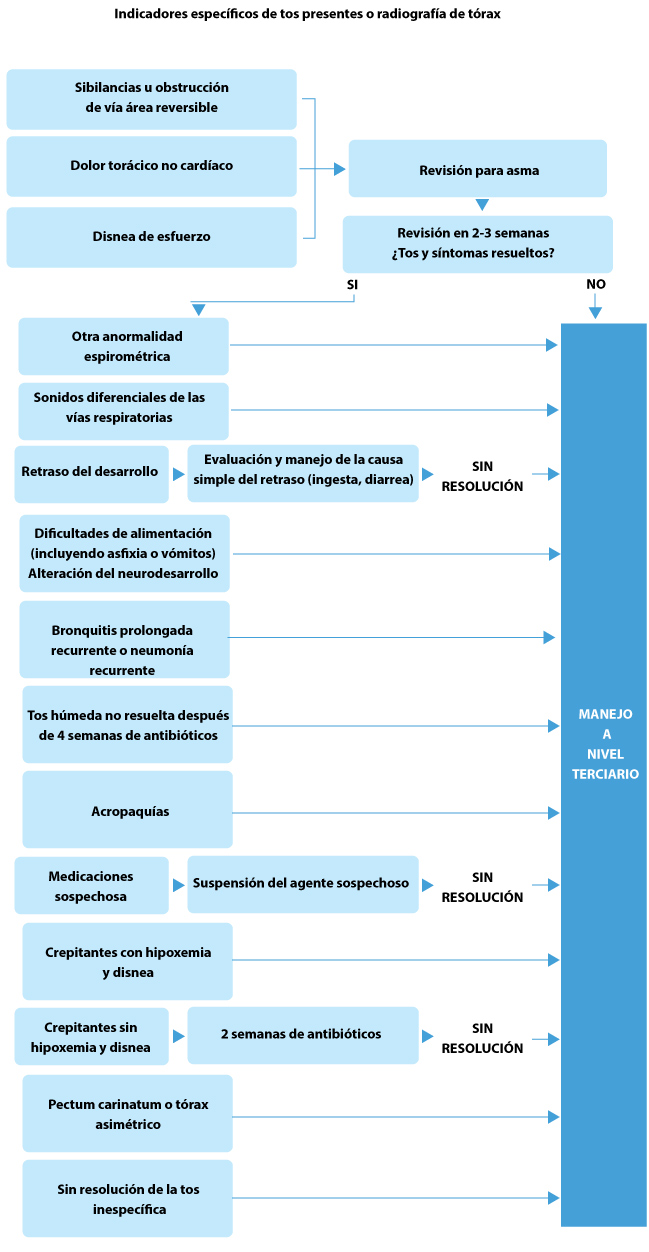
El día 28, los niños con tos persistente del grupo de intervención fueron revisados por un pediatra dentro de las siguientes 2 semanas y la tos se manejó según un algoritmo de manejo de tos crónica basado en evidencia y compuesto por dos vías, una para niños con tos inespecífica y la segunda para niños con puntos específicos para la tos (Figuras 1, 2).
Los padres fueron contactados 2 semanas después de la cita inicial con el pediatra y, si la tos no había resuelto, se organizó un segundo control (por el mismo médico). Los niños que requirieron más de dos revisiones fueron derivados posteriormente a una clínica respiratoria pediátrica terciaria.
Los niños del grupo control no recibieron un tratamiento específico en el estudio. Se aconsejó a los padres buscar atención médica si estaban preocupados o bien seguir autogestionando la tos de sus hijos. Si aún seguían tosiendo al día 56 se les ofreció la revisión por un pediatra del estudio, y desde ese punto, manejo de acuerdo con el algoritmo propuesto.
Se recolectaron datos demográficos, clínicos y socioeconómicos de todos los niños al inicio y semanalmente por 8 semanas (56 días) después del enrolamiento, independientemente de la randomización al día 28.11
El resultado primario fue la resolución de la tos en el día 56, definida como ausencia de tos durante al menos 3 días y noches desde el día 28, y determinada por el informe semanal de los padres sobre un historial de tos de 3 días, o por una reducción de más del 75% en el puntaje promedio de tos diurna y nocturna (basado en una escala de puntaje de tos validada12) en el día 56 en comparación con el día 28.
Los niños fueron clasificados como con tos persistente si la tos no tenía un descanso de 3 días o una reducción del puntaje de tos durante el periodo total de estudio de 8 semanas, y como con tos de resultado desconocido si hubo al menos 1 semana de falta seguimiento y no se informó un descanso de 3 días en la tos en otros puntos de tiempo. El resultado secundario fue si predictores epidemiológicos, culturales, clínicos o socioeconómicos podrían identificar el éxito o el fracaso de la intervención.
| Resultados |
Dos niños fueron excluidos por violaciones del protocolo, por lo que 115 niños fueron incluidos en el análisis de intención de tratar (ITT), con 57 asignados al grupo de intervención y 58 al grupo control. Del total, 45 niños (39%) eran indígenas, la mediana de edad fue de 1,6 años (RIC 1,0 – 4,5), y 59 (51%) eran varones.
En el grupo de intervención, 41 (72%) de los 57 niños fueron revisados por el pediatra del estudio a una mediana de 9 días (RIC 6–14) después de la randomización.
Para los 16 niños restantes, los padres de 11 rechazaron la consulta, tres niños se perdieron en el seguimiento, y uno resolvió la tos antes de su cita. Además, un niño se mudó a un área remota y no pudo asistir dentro del plazo requerido.
Entre el grupo control, 32 niños todavía tenían tos crónica en el día 56. De estos 32 niños, 21 asistieron a la revisión de estudio recomendada.
De los 11 niños restantes, tres se perdieron en el seguimiento después del día 56, dos cancelaron sus citas repetidamente y en ambos casos el niño finalmente dejó de toser, los padres de otros tres niños decidieron no aceptar la cita, y tres padres buscaron especialistas de forma independiente para el manejo de la tos de sus hijos en otro lugar.
Para el día 56, 33 (58%) de 57 niños del grupo intervención tuvieron resolución de la tos en comparación con 23 (40%) de 58 en el grupo control. La resolución de la tos para el día 56 fue desconocida en 12 (21%) niños del grupo de intervención y en 13 (22%) del grupo control.
Usando ITT (suponiendo conservadoramente que los niños cuyo estado de la tos al día 56 era desconocido tenían tos persistente), la diferencia de riesgo absoluto (DRabs) fue del 18,3% (IC 95% 0,3–36,2) y el número de tratamientos necesarios para obtener un beneficio fue de cinco (IC 95%: 3-364).
El OR ajustado para predecir la resolución de la tos fue de 1,5 (IC 95% 1,3 - 1,6), a favor del grupo de intervención. Repitiendo el análisis con un estado de tos desconocido al día 56 clasificado como resuelto, el OR ajustado fue de 1,4 (IC 95% 1,0 - 2,0) a favor del grupo de intervención. En el análisis por protocolo, el OR ajustado para la resolución de la tos fue de 1,7 (IC 95% 1, - 2,2) a favor del grupo de intervención.
| Discusión |
En comparación con el grupo control, los niños del grupo de intervención tuvieron 1,5 veces más probabilidades de haber dejado de toser 56 días después de la consulta inicial a un servicio de salud.Los predictores independientes de los resultados para la tos que mostraron fuertes asociaciones fueron el sitio de estudio, la edad al enrolamiento, seguro de salud privado, número de habitaciones del hogar e ingreso a una unidad de cuidados intensivos neonatales para tratamiento de problemas respiratorios después del nacimiento. Estos factores también se asociaron con el estado de tos desconocida al día 56.
Para el conocimiento de los autores, este fue el primer ECA de tos crónica que reclutó niños de la comunidad y no de clínicas especializadas. También fue el primero en evaluar los resultados de niños con tos poco tiempo después de que se volviera crónica, una situación que es más probable que sea capturada en un entorno de atención primaria. En tercer lugar, fue el segundo estudio en evaluar el uso de un algoritmo de manejo de tos crónica en pacientes pediátricos.
El primer ECA10 que evaluó la eficacia de este algoritmo incluyó solo a niños derivados a clínicas especializadas en patología respiratoria y la mediana de duración de la tos al enrolamiento fue mayor (16 semanas).
Su DRabs reportada de 24,7%10 en la semana 6 no fue muy diferente a la del presente estudio (18,3%) después de 4 semanas, sugiriendo que este algoritmo también podría usarse dentro de la comunidad, ayudando a disminuir la sustancial carga de tos sobre los niños, sus familias y el sistema de salud.4,17
Sin embargo, es probable que la implementación del algoritmo en atención primaria requiera educación adicional para que los profesionales de la salud puedan reconocer los llamados puntos específicos de la tos y su significación clínica.
La prevalencia de las diferentes causas de tos crónica es dependiente de la edad y el entorno.18 Por lo tanto, no sorprende que menos niños en este ECA tuvieran un trastorno de base grave. Sin embargo, las causas predominantes para la tos crónica fueron la bronquitis bacteriana prolongada y el asma.19,20 Estas condiciones son identificadas rápidamente en los algoritmos de manejo de la tos15 y su manejo inmediato y adecuado probablemente haya contribuido a la efectividad observada en niños con tos crónica establecida.
Este ECA debe interpretarse considerando varios factores. En primer lugar, los análisis de subgrupos no fueron factibles. Además, los modelos de regresión sugirieron que el sitio de estudio, la edad, el nivel socioeconómico y el ingreso en la UCIN por problemas respiratorios estaban asociados con los resultados para la tos conocida o desconocida.
Sin embargo, es posible que varios otros factores importantes (asistencia a guarderías, historia previa de tos crónica, población indígena y estación del año) se asocien con estos resultados. Se desconoce por qué el estado socioeconómico puede influir en los resultados, pero podría estar asociado con la captación de la intervención.
En comparación con los niños captados en departamentos de emergencias, los niños matriculados en atención primaria fueron menos propensos a resolver la tos al día 56.
Las asociaciones observadas podrían ser un factor de mayor carga de tos crónica y de causas crónicas subyacentes en las comunidades indígenas atendidas por estas prácticas de atención primaria. Esto se observó en el estudio previo de los autores,19 que mostró diferencias en las intervenciones médicas para la tos en el departamento de emergencias en comparación con la atención primaria, y en las relaciones que los investigadores tenían con las comunidades.
La edad del niño al momento del enrolamiento se identificó como un predictor independiente del resultado de la tos, con los niños menores de 2 años teniendo menos probabilidades de resolver la tos y de tener un estado de tos desconocido al día 56.
Es posible que estos niños pequeños, con mayores tasas de infección respiratoria, pudieran haber desarrollado infección por otras causas, ya que la resolución de la tos se definió como 3 días sin tos o 75% de reducción durante 3 días.
Los puntos fuertes de este ECA fueron su enfoque multicéntrico que aumentó la generalización de los hallazgos, y su inclusión dentro de un estudio de cohorte más amplio que permitió el monitoreo de la duración de la tos desde el inicio de la enfermedad para garantizar que los niños cumplieran con los criterios de tos persistente durante al menos 4 semanas.
La proporción de niños enrolados con tos crónica confirmada al día 28 (117 [23%] de 509) estuvo dentro del rango de 20 a 27% observado en otros estudios que utilizaron los mismos métodos de cohorte en ambientes similares o iguales.20,26 Este hallazgo contrasta con una revisión sistemática que sugirió que solo el 10% de los niños que se presentan en atención primaria o en el departamento de emergencias seguirá teniendo tos 3 semanas después de una infección respiratoria aguda.27
Sin embargo, la población del presente estudio tuvo varias diferencias claves con las de los estudios que formaron la revisión, incluyendo la evaluación de la tos a las 4 semanas y no a las 3 semanas,27 el enrolamiento de una alta proporción de niños aborígenes e isleños y de aquellos con factores de riesgo como antecedentes de tos crónica, parto prematuro, ingreso a UCIN al nacer por problemas respiratorios, infecciones recurrentes, y hospitalización en los 12 meses previos por enfermedad respiratoria.
La limitación más importante de este estudio es no haber logrado el tamaño de muestra requerido para abordar adecuadamente los sesgos, los factores de confusión y las potenciales diferencias de subgrupos en los resultados de los modelos de regresión. Sin embargo, la DRabs estuvo en el rango de lo reportado en el estudio pivotal del algoritmo de tos crónica en niños,10 y el hallazgo fue consistente. Además, las limitaciones de tiempo y presupuesto obligaron a adaptar el protocolo, aunque las diferencias entre grupos fueron similares a las de ECAs de mayor tamaño.10
Este estudio refleja lo que es probable que ocurra con respecto al compromiso y seguimiento del paciente si la intervención es incorporada a la atención clínica de niños en las fases iniciales de la tos crónica.
La evaluación y manejo del niño estuvo a cargo de pediatras capacitados dentro de las 2 semanas de identificación de la tos crónica, lo que es poco probable que ocurra en muchas jurisdicciones dada la disponibilidad de atención especializada o los potenciales costos del tratamiento para las familias, o ambos.
Por lo tanto, el algoritmo debería implementarse y evaluarse en atención primaria y en controles de seguimiento para niños dados de alta del departamento de emergencias o del hospital. Finalmente, como este estudio incluyó niños de comunidades con mayor riesgo de enfermedades respiratorias, los resultados pueden no ser generalizables.
La generalización también estuvo influenciada por la elección de 4 semanas como punto para la definición de tos crónica de acuerdo con la mayoría de las guías nacionales (incluyendo Australia y EE. UU.),8 pero no con las directrices británicas.
Sin embargo, los efectos observados fueron consistentes con el primer estudio del algoritmo en niños, y además, la mayoría de los niños fueron diagnosticados con condiciones que respondieron bien a intervenciones apropiadas y tempranas, y por lo tanto, se consideraron las 4 semanas como un punto de tiempo ideal en el cual el manejo y la prevención de la tos crónica debían ser implementados.
A pesar de las limitaciones, este estudio contribuye a la evidencia8 de que los algoritmos de manejo de la tos mejoran la resolución de la tos en niños al implementarse poco después de la fase de transición de tos aguda a crónica.
La identificación temprana y el manejo de la tos crónica es crucial para mejorar la calidad de vida y el diagnóstico temprano de trastornos pulmonares crónicos subyacentes. Se necesita más investigación sobre cómo implementar los hallazgos en entornos de atención primaria y para abordar cualquier diferencia en subgrupos potencialmente importantes.
(Ver Figuras 1 y 2 a continuación)
Referencias bibliográficas
1 Britt H, Miller GC, Bayram C, et al. A decade of Australian general practice activity 2006–07 to 2015–16. General practice series no 41. Sydney: Sydney University Press, 2016.
2 Centres for Disease Control and Prevention. National Hospital Ambulatory Medical Care Survey: 2010 Outpatient Department Summary Tables. Atlanta, GA: US Department of Health and Human Services, 2010.
3 Kantar A. Update on pediatric cough. Lung 2016; 194: 9–14.
4 Marchant JM, Newcombe PA, Juniper EF, Sheffield JK, Stathis SL, Chang AB. What is the burden of chronic cough for families? Chest 2008; 134: 303–09.
5 Marchant JM, Masters IB, Taylor SM, Cox NC, Seymour GJ, Chang AB. Evaluation and outcome of young children with chronic cough. Chest 2006; 129: 1132–41.
6 Chang AB, Redding GJ, Everard ML. Chronic wet cough: protracted bronchitis, chronic suppurative lung disease and bronchiectasis. Pediatr Pulmonol 2008; 43: 519–31.
7 Chang AB, Robertson CF, Van Asperen PP, et al. A multicenter study on chronic cough in children: burden and etiologies based on a standardized management pathway. Chest 2012; 142: 943–50.
8 Chang AB, Oppenheimer JJ, Weinberger MM, et al. Use of management pathways or algorithms in children with chronic cough: CHEST guideline and expert panel report. Chest 2017; 151: 875–83.
9 Shields MD, Bush A, Everard ML, McKenzie S, Primhak R. BTS guidelines: recommendations for the assessment and management of cough in children. Thorax 2008; 63 (suppl 3): iii1–15.
10 Chang AB, Robertson CF, van Asperen PP, et al. A cough algorithm for chronic cough in children: a multicenter, randomized controlled study. Pediatrics 2013; 131: e1576–83.
11 O’Grady KF, Grimwood K, Toombs M, et al. Effectiveness of a cough management algorithm at the transitional phase from acute to chronic cough in Australian children aged <15 years: protocol for a randomised controlled trial. BMJ Open 2017; 7: e013796.
12 Chang AB, Newman RG, Carlin JB, Phelan PD, Robertson CF. Subjective scoring of cough in children: parent-completed vs child-completed diary cards vs an objective method. Eur Respir J 1998; 11: 462–66.
13 Ridgeon EE, Young PJ, Bellomo R, Mucchetti M, Lembo R, Landoni G. The fragility index in multicenter randomized controlled critical care trials. Crit Care Med 2016; 44: 1278–84.
14 Hosmer DW, Lemeshow S. Applied logistic regression. New York: Wiley, 1989.
15 Chang AB, Robertson CF, van Asperen PP, et al. Can a management pathway for chronic cough in children improve clinical outcomes: protocol for a multicentre evaluation. Trials 2010; 11: 103.
16 Chang AB, Oppenheimer JJ, Weinberger M, Weir K, Rubin BK, Irwin RS. Use of management pathways or algorithms in children with chronic cough: systematic reviews. Chest 2016; 149: 106–19.
17 Lovie-Toon YG, Chang AB, Newcombe PA, et al. Longitudinal study of quality of life among children with acute respiratory infection and cough. Qual Life Res 2018; 27: 891–903.
18 Chang AB, Oppenheimer JJ, Weinberger M, et al. Etiologies of chronic cough in pediatric cohorts: CHEST guideline and expert panel report. Chest 2017; 152: 607–17.
19 Hall KK, Chang AB, Anderson J, et al. The incidence and short term outcomes of acute respiratory illness with cough in children from a socioeconomically disadvantaged urban community in Australia: a community-based prospective cohort study. Front Pediatr 2017; 5: 228.
20 O’Grady KF, Drescher BJ, Goyal V, et al. Chronic cough post acute respiratory illness in children: a cohort study. Arch Dis Child 2017; 102: 1044–48.
21 Chang AB, Robertson CF, Van APP, et al. A multi-centre study on chronic cough in children: burden and etiologies based on a standardized management pathway. Chest 2012; 142: 943–50.
22 Queensland Government Statistical Office. Aboriginal and Torres Strait Islander peoples in Queensland, Census 2016. 2017. http://www.qgso.qld.gov.au/products/reports/atsi-pop-qld-c16/atsipop-qld-c16.pdf (accessed May 10, 2019).
23 O’Grady KA, Chang AB. Lower respiratory infections in Australian Indigenous children. J Paediatr Child Health 2010; 46: 461–65.
24 Chang AB, Brown N, Toombs M, Marsh RL, Redding GJ. Lung disease in indigenous children. Paediatr Respir Rev 2014; 15: 325–32.
25 Singleton RJ, Valery PC, Morris P, et al. Indigenous children from three countries with non-cystic fibrosis chronic suppurative lung disease/bronchiectasis. Pediatr Pulmonol 2014; 49: 189–200.
26 Hall KK, Chang AB, Anderson J, Dunbar M, Arnold D, O’Grady KF. Characteristics and respiratory risk profile of children aged less than 5 years presenting to an urban, Aboriginal-friendly,
comprehensive primary health practice in Australia. J Paediatr Child Health 2017; 53: 636–43.
27 Thompson M, Vodicka TA, Blair PS, et al. Duration of symptoms of respiratory tract infections in children: systematic review. BMJ 2013; 347: f7027.
Fuente:
2 Centres for Disease Control and Prevention. National Hospital Ambulatory Medical Care Survey: 2010 Outpatient Department Summary Tables. Atlanta, GA: US Department of Health and Human Services, 2010.
3 Kantar A. Update on pediatric cough. Lung 2016; 194: 9–14.
4 Marchant JM, Newcombe PA, Juniper EF, Sheffield JK, Stathis SL, Chang AB. What is the burden of chronic cough for families? Chest 2008; 134: 303–09.
5 Marchant JM, Masters IB, Taylor SM, Cox NC, Seymour GJ, Chang AB. Evaluation and outcome of young children with chronic cough. Chest 2006; 129: 1132–41.
6 Chang AB, Redding GJ, Everard ML. Chronic wet cough: protracted bronchitis, chronic suppurative lung disease and bronchiectasis. Pediatr Pulmonol 2008; 43: 519–31.
7 Chang AB, Robertson CF, Van Asperen PP, et al. A multicenter study on chronic cough in children: burden and etiologies based on a standardized management pathway. Chest 2012; 142: 943–50.
8 Chang AB, Oppenheimer JJ, Weinberger MM, et al. Use of management pathways or algorithms in children with chronic cough: CHEST guideline and expert panel report. Chest 2017; 151: 875–83.
9 Shields MD, Bush A, Everard ML, McKenzie S, Primhak R. BTS guidelines: recommendations for the assessment and management of cough in children. Thorax 2008; 63 (suppl 3): iii1–15.
10 Chang AB, Robertson CF, van Asperen PP, et al. A cough algorithm for chronic cough in children: a multicenter, randomized controlled study. Pediatrics 2013; 131: e1576–83.
11 O’Grady KF, Grimwood K, Toombs M, et al. Effectiveness of a cough management algorithm at the transitional phase from acute to chronic cough in Australian children aged <15 years: protocol for a randomised controlled trial. BMJ Open 2017; 7: e013796.
12 Chang AB, Newman RG, Carlin JB, Phelan PD, Robertson CF. Subjective scoring of cough in children: parent-completed vs child-completed diary cards vs an objective method. Eur Respir J 1998; 11: 462–66.
13 Ridgeon EE, Young PJ, Bellomo R, Mucchetti M, Lembo R, Landoni G. The fragility index in multicenter randomized controlled critical care trials. Crit Care Med 2016; 44: 1278–84.
14 Hosmer DW, Lemeshow S. Applied logistic regression. New York: Wiley, 1989.
15 Chang AB, Robertson CF, van Asperen PP, et al. Can a management pathway for chronic cough in children improve clinical outcomes: protocol for a multicentre evaluation. Trials 2010; 11: 103.
16 Chang AB, Oppenheimer JJ, Weinberger M, Weir K, Rubin BK, Irwin RS. Use of management pathways or algorithms in children with chronic cough: systematic reviews. Chest 2016; 149: 106–19.
17 Lovie-Toon YG, Chang AB, Newcombe PA, et al. Longitudinal study of quality of life among children with acute respiratory infection and cough. Qual Life Res 2018; 27: 891–903.
18 Chang AB, Oppenheimer JJ, Weinberger M, et al. Etiologies of chronic cough in pediatric cohorts: CHEST guideline and expert panel report. Chest 2017; 152: 607–17.
19 Hall KK, Chang AB, Anderson J, et al. The incidence and short term outcomes of acute respiratory illness with cough in children from a socioeconomically disadvantaged urban community in Australia: a community-based prospective cohort study. Front Pediatr 2017; 5: 228.
20 O’Grady KF, Drescher BJ, Goyal V, et al. Chronic cough post acute respiratory illness in children: a cohort study. Arch Dis Child 2017; 102: 1044–48.
21 Chang AB, Robertson CF, Van APP, et al. A multi-centre study on chronic cough in children: burden and etiologies based on a standardized management pathway. Chest 2012; 142: 943–50.
22 Queensland Government Statistical Office. Aboriginal and Torres Strait Islander peoples in Queensland, Census 2016. 2017. http://www.qgso.qld.gov.au/products/reports/atsi-pop-qld-c16/atsipop-qld-c16.pdf (accessed May 10, 2019).
23 O’Grady KA, Chang AB. Lower respiratory infections in Australian Indigenous children. J Paediatr Child Health 2010; 46: 461–65.
24 Chang AB, Brown N, Toombs M, Marsh RL, Redding GJ. Lung disease in indigenous children. Paediatr Respir Rev 2014; 15: 325–32.
25 Singleton RJ, Valery PC, Morris P, et al. Indigenous children from three countries with non-cystic fibrosis chronic suppurative lung disease/bronchiectasis. Pediatr Pulmonol 2014; 49: 189–200.
26 Hall KK, Chang AB, Anderson J, Dunbar M, Arnold D, O’Grady KF. Characteristics and respiratory risk profile of children aged less than 5 years presenting to an urban, Aboriginal-friendly,
comprehensive primary health practice in Australia. J Paediatr Child Health 2017; 53: 636–43.
27 Thompson M, Vodicka TA, Blair PS, et al. Duration of symptoms of respiratory tract infections in children: systematic review. BMJ 2013; 347: f7027.
Fuente:
No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.