GSK presenta la creciente evidencia que avala su amplio portafolio de medicamentos respiratorios en el congreso de la European Respiratory Society (ERS) que se celebra en París (Francia) del 15 al 19 de septiembre de 2018. Los datos presentados en 50 abstracts destacan el valor terapéutico de medicamentos clave en un amplio espectro de pacientes con asma y enfermedad pulmonar obstructiva crónica (EPOC).
Los datos presentados incluyen nuevos análisis de estudios clínicos realizados en todo el portfolio de medicamentos. Estos datos demuestran el papel que desempeñan los diferentes tratamientos en la optimización del manejo de las enfermedades respiratorias, abordando las principales áreas de necesidad de cada paciente. Los resultados incluyen el efecto sobre las exacerbaciones, o el empeoramiento de la enfermedad, que sufren muchos pacientes con EPOC y asma, así como sobre la función pulmonar, los síntomas como la disnea y la calidad de vida. También se presentan datos sobre la evaluación de los beneficios de los tratamientos en función de la gravedad de la enfermedad y los grupos de edad.
Optimizar el tratamiento de la EPOC
Los nuevos análisis de los datos del estudio de referencia IMPACT —en el que han participado 10.355 pacientes, de los cuales 502 pacientes fueron reclutados en 58 centros españoles— ayudan a aclarar qué pacientes del estudio podrán beneficiarse en mayor medida de las diferentes combinaciones de tratamientos para la EPOC, con el objetivo de proporcionar datos adicionales sobre el tratamiento adecuado para cada paciente.
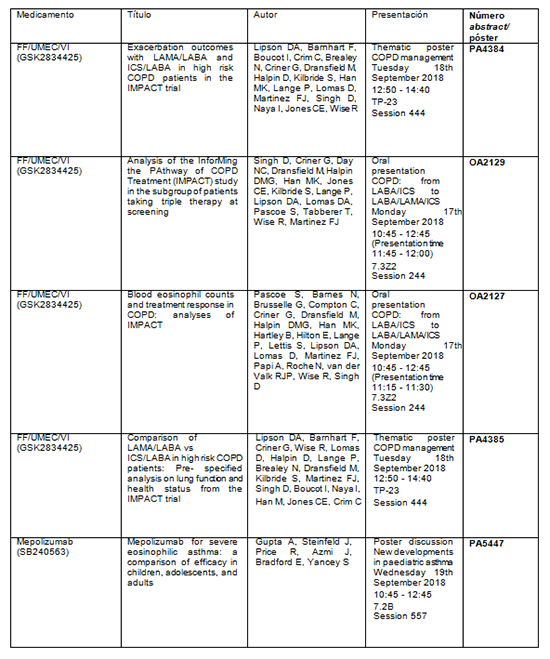
· En un análisis adicional se presenta el perfil de la relación beneficio-riesgo de la triple terapia en un único inhalador de una sola dosis diaria, Trelegy Ellipta (furoato de fluticasona/umeclidinio/vilanterol, FF/UMEC/VI) en pacientes con EPOC con antecedentes de exacerbaciones (N.º de abstract: PA1991).
· Por primera vez, se presentan las comparaciones de las dos dobles terapias evaluadas en el estudio IMPACT, Anoro Ellipta (UMEC/VI) y Relvar Ellipta (FF/VI), que proporcionan evidencia adicional sobre el papel de la doble broncodilatación en el tratamiento de los síntomas de la EPOC (N.º de abstract: PA4384, PA4385).
Consolidar la evidencia científica para nuestra terapia biológica dirigida
El desarrollo de Nucala (mepolizumab), el primer tratamiento biológico anti-IL5, representa una innovación científica que da lugar a un enfoque más dirigido para el tratamiento de los pacientes con asma eosinofílica grave y granulomatosis eosinofílica con poliangitis. Además, se está evaluando Nucala en pacientes con EPOC, síndrome hipereosinofílico y pólipos nasales. Las presentaciones más importantes que van a tener lugar durante el congreso se centran en un número cada vez mayor de pruebas que evalúan su papel en la reducción de las exacerbaciones en una serie de pacientes de diferentes grupos de edad y con diferentes grados de intensidad de asma eosinofílica grave.
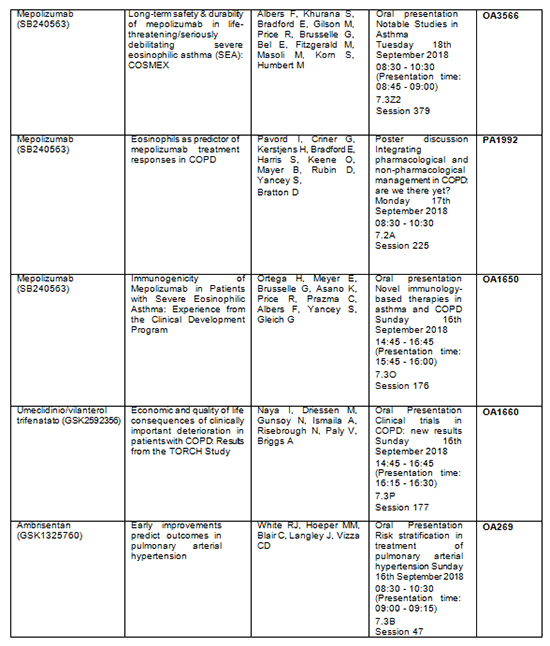
· Los nuevos resultados del estudio COSMEX analizan la seguridad a largo plazo y la durabilidad en pacientes con asma eosinofílica grave potencialmente mortal/gravemente debilitante durante al menos 4,5 años (N.º de abstract: OA3566).
· Se presentarán datos de eficacia en los que se comparan el efecto del tratamiento en investigación en niños con asma eosinofílica grave con los resultados en adolescentes y adultos (N.º de abstract: PA5447).
En total, GSK presenta datos de 50 abstracts, que incluyen 13 presentaciones orales, 16 debates y 21 presentaciones temáticas con posters.
Tabla resumen de los principales abstracts:
Acerca del asma
El asma es una enfermedad pulmonar crónica que inflama y estrecha las vías respiratorias. Esta enfermedad afecta a 358 millones de personas en todo el mundo. Pese a los avances de la medicina, más de la mitad de los pacientes con asma siguen experimentando un control deficiente y síntomas significativos que afectan a su vida diaria. Se estima que del 5 al 10% de todos los pacientes con asma tienen asma grave.
Las causas del asma no se conocen completamente, pero es probable que estén relacionadas con una interacción entre la dotación genética de una persona y el entorno. Los factores de riesgo clave son las sustancias inhaladas que causan reacciones alérgicas o irritan las vías respiratorias.
Acerca de la EPOC
La EPOC es una enfermedad de los pulmones que incluye bronquitis crónica, enfisema o ambos, y limita el flujo aéreo a los pulmones, interfiriendo con la respiración normal. Se cree que afecta a 384 millones de personas en todo el mundo. Para las personas que viven con EPOC la imposibilidad de respirar normalmente y el empeoramiento de sus síntomas impacta en su vida diaria y hace que actividades sencillas como subir las escaleras se conviertan en un verdadero reto.
La exposición prolongada a partículas nocivas daña los pulmones y las vías respiratorias, es una de las causas de la EPOC. El humo de los cigarros, ser fumador pasivo, la polución ambiental, el polvo del medio ambiente o del lugar de trabajo también pueden contribuir al desarrollo de la EPOC. La mayoría de las personas que padecen la EPOC tienen al menos 40 años cuando empiezan a presentar síntomas.
Cada persona con EPOC es diferente, con necesidades diferentes, retos diferentes y metas distintas. La base del trabajo de GSK consiste en comprender esta situación y proporcionar apoyo para ayudar a satisfacer estas necesidades.
Acerca de Trelegy Ellipta (FF/UMEC/VI)
FF/UMEC/VI es el primer tratamiento de la EPOC que consiste en una combinación de tres moléculas en un único inhalador que se administra en una única inhalación una vez al día. Contiene furoato de fluticasona (un corticosteroide inhalado), umeclidinio (un antagonista muscarínico de acción prolongada) y vilanterol (un agonista adrenérgico beta2 de acción prolongada) y se administra en polvo seco con el inhalador Ellipta de GSK, el cual es utilizado en todos los nuevos medicamentos inhalados para la EPOC de GSK. Datos de varios programas de ensayos clínicos han demostrado los efectos beneficiosos de FF, UMEC y VI tanto en monoterapia como en combinación para el tratamiento de la EPOC.
FF/UMEC/VI fue aprobado en Europa como tratamiento de mantenimiento en pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC) de moderada a grave, que no están adecuadamente controlados con la combinación de un corticosteroide inhalado y un agonista β2 de acción prolongada. La ficha técnica del producto en Europa está disponible en:
https://www.medicines.org.uk/emc/medicine/34357
FF/UME /VI FUE aprobado en los EEUU como tratamiento de mantenimiento a largo plazo, una vez al día, de la obstrucción del flujo de aire en pacientes con EPOC, que incluye bronquitis crónica y / o enfisema. También está indicado para reducir las exacerbaciones de la EPOC en pacientes con antecedentes de exacerbaciones. No está indicado para el alivio del broncoespasmo agudo o para el tratamiento del asma.
La información completa de prescripción de EEUU, incluida la información para el paciente, está disponible en: https://www.gsksource.com
Se han presentado solicitudes de autorización de comercialización para el tratamiento triple con FF/UMEC/VI administrado una vez al día en único inhalador a las autoridades sanitarias de otros países, que están siendo evaluadas.
Información de seguridad importante de Trelegy Ellipta
La siguiente información importante sobre la seguridad de Trelegy Ellipta (FF/UMEC/VI) se basa en la sección destacada de la ficha técnica completa del producto de EE.UU. Para conocer toda la información sobre su seguridad, consulte la información de prescripción completa.
Trelegy Ellipta está contraindicada en pacientes con hipersensibilidad grave a las proteínas de la leche o cualquiera de sus ingredientes. LABA en monoterapia aumenta el riesgo de eventos graves relacionados con el asma.
Trelegy Ellipta no debe utilizarse en pacientes con episodios de exacerbaciones agudas de enfermedad pulmonar obstructiva crónica (EPOC). No utilice Trelegy Ellipta para tratar los síntomas agudos.
Trelegy Ellipta no debe emplearse en combinación con otros medicamentos que contengan LABA por riesgo de sobredosis.
Se han producido casos de infecciones por el hongo candida albicans en la boca y la faringe de pacientes tratados con fluticasona furoato, un componente de Trelegy Ellipta. Realizar seguimiento de los pacientes de forma periódica. Aconseje al paciente que se enjuague la boca con agua y que no la trague tras la inhalación para ayudar a reducir el riesgo.
Existe un aumento del riesgo de neumonía en pacientes con EPOC que están usando Trelegy Ellipta. Ha de realizarse seguimiento de aquellos pacientes con signos y síntomas de neumonía.
Los pacientes que utilizen corticosteroides corren el riesgo de un posible empeoramiento de infecciones (por ejemplo, tuberculosis, infecciones por hongos, bacterias, virus o parásitos o herpes simple ocular). Use Trelegy Ellipta con precaución en pacientes con estas infecciones. Pacientes vulnerables puede padecer eventos más graves o incluso mortales de varicela o sarampión.
Existe un riesgo de alteración de la función suprarrenal cuando se transfieren de los corticosteroides sistémicos. Reducir gradualmente los pacientes con corticosteroides sistémicos si se transfiere a Trelegy Ellipta.
El hipercorticismo y la supresión suprarrenal pueden ocurrir con dosis muy altas o con la dosis regular de Trelegy Ellipta en individuos vulnerables. Si se producen dichos cambios, debe de considerarse la terapia.
Si se produce un broncoespasmo paradójico, suspenda Trelegy Ellipta y utilice una terapia alternativa.
Emplee Trelegy Ellipta con precaución en pacientes con trastornos cardiovasculares debido a la estimulación beta-adrenérgica.
Evaluar inicial y periódicamente a pacientes con disminución de la densidad mineral ósea tras la prescripción de Trelegy Ellipta.
Se recomienda un estrecho seguimiento de pacientes con glaucoma y cataratas que usan Trelegy Ellipta. Puede haber un empeoramiento del glaucoma de ángulo cerrado. Use Trelegy Ellipta con precaución en pacientes con glaucoma de ángulo cerrado y pida a los pacientes que, en caso de tener síntomas, se comuniquen de inmediato con un profesional sanitario.
El empeoramiento de la retención urinaria puede ocurrir en pacientes que toman Trelegy Ellipta. Usar con precaución en pacientes con hiperplasia prostática u obstrucción del cuello de la vejiga e instruir a los pacientes a ponerse en contacto de inmediato con un profesional sanitario si se presentan síntomas.
Use Trelegy Ellipta con precaución en pacientes con trastornos convulsivos, tirotoxicosis, diabetes mellitus y cetoacidosis.
Esté alerta a la hipocalemia y la hiperglucemia en pacientes que toman Trelegy Ellipta.
Las reacciones adversas más comunes reportadas para Trelegy Ellipta (incidencia ≥1%) son infección del tracto respiratorio superior, neumonía, bronquitis, candidiasis oral, dolor de cabeza, dolor de espalda, artralgias, influenza, sinusitis, faringitis, rinitis, disgeusia, estreñimiento, infección del tracto urinario, diarrea, gastroenteritis, dolor orofaríngeo, tos y disfonía
Sobre Nucala (mepolizumab)
Nucala 100mg es un tratamiento biológico líder del mercado para pacientes con asma eosinofílica grave en Estados Unidos, Europa y otros 20 países y se ha prescrito a más de 18.000 en EEUU. Se ha estudiado en 16 ensayos clínicos en los que han participado más de 3.000 pacientes con diversos trastornos eosinofílicos. Nucala 300mg está aprobado en Estados Unidos para el tratamiento de pacientes adultos con una enfermedad rara llamada granulomatosis eosinofílica con poliangiitis (GEPA). También se ha presentado la solicitud de autorización de comercialización de producto biológico para Nucala para el tratamiento de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y actualmente se está investigando como tratamiento del el síndrome hipereosinofílico grave y la poliposis nasal.
En Estados Unidos, Nucala (inyección subcutánea de mepolizumab en dosis fija de 100 mg) está aprobado para su uso como tratamiento de mantenimiento complementario para pacientes que presentan asma grave de 12 años de edad en adelante y con fenotipo eosinofílico. Nucala (3x100mg inyección subcutánea de mepolizumab) está aprobado para el tratamiento de pacientes adultos con GEPA. Nucala no está aprobado para el alivio del broncoespasmo agudo o del estado asmático. La información de prescripción completa de EEUU está disponible eninformación de prescripción de Nucala en EEUU.
En la UE, Nucala (inyección subcutánea de mepolizumab en dosis fija de 100 mg) está aprobado como tratamiento complementario del asma grave eosinofílica refractaria en pacientes adultos. Si desea consultar el resumen de características del producto de la UE de Nucala, visite: http://www.ema.europa.eu
Información de seguridad importante para Nucala en España
La siguiente información importante de seguridad se basa en una síntesis de la ficha técnica europea y la información de prescripción de Estados Unidos para Nucala. Para obtener la información completa de seguridad de Nucala, consulte la ficha técnica y la información de prescripción completos para Nucala en: http://www.ema.europa.eu.
Nucala está contraindicado en pacientes con hipersensibilidad a mepolizumab o a cualquiera de sus excipientes. Nucala no debe utilizarse para tratar exacerbaciones agudas del asma.
Durante el tratamiento pueden aparecer acontecimientos adversos o exacerbaciones del asma. Debe indicarse a los pacientes que busquen asistencia médica si su asma permanece no controlada o empeora después del inicio del tratamiento.
No se recomienda la interrupción brusca de los corticosteroides después del inicio del tratamiento con Nucala. La reducción de la dosis de corticosteroides, si es necesaria, debe realizarse de forma gradual y bajo supervisión médica.
Después de la administración de Nucala han aparecido reacciones sistémicas agudas y tardías, incluyendo reacciones de hipersensibilidad (por ejemplo, anafilaxia, urticaria, angioedema, sarpullido, broncoespasmo, hipotensión). Estas reacciones generalmente ocurren en las horas siguientes a la administración, pero en algunos casos tienen un inicio tardío (por ejemplo, en algunos días). Estas reacciones pueden aparecer por primera vez después de tiempo prolongado de tratamiento.
Los eosinófilos pueden participar en la respuesta inmunológica a algunas infecciones por helmintos. Los pacientes con infecciones ya existentes por helmintos deberían ser tratados de las mismas antes de comenzar el tratamiento con Nucala. Si los pacientes se infectasen mientras reciben el tratamiento con Nucala y no responden al tratamiento anti-helmintos, debería considerarse la interrupción temporal de la terapia.
Durante los ensayos clínicos en sujetos con asma grave eosinofílica refractaria, las reacciones adversas notificadas más comúnmente fueron dolor de cabeza, reacciones en el sitio de inyección y dolor de espalda. El dolor de cabeza fue considerado muy común, apareciendo con una frecuencia de ≥1/10. Las reacciones adversas al medicamento comunes (≥1/100 a <1/10) incluyeron: infecciones de las vías respiratorias inferiores, infecciones de las vías urinarias, faringitis, reacciones de hipersensibilidad (sistémicas, alérgicas), congestión nasal, dolor en el abdomen superior, eccema, dolor de espalda, reacciones relacionadas con la administración (sistémicas, no alérgicas), reacciones locales en el sitio de inyección y pirexia.
Las reacciones en el sitio de inyección (por ejemplo, dolor, eritema, inflamación, picor y sensación de ardor) ocurrieron en una proporción del 8% en sujetos tratados con Nucala en comparación con el 3% en sujetos tratados con placebo.
I Premio al Periodismo en Respiratorio ‘Innovamos para respirar’
GSK ha convocado el I Premio al Periodismo en Respiratorio ‘Innovamos para respirar’, que tiene como objetivo premiar y reconocer públicamente el trabajo de los periodistas y medios de comunicación que hayan promovido el conocimiento del asma y la EPOC, así como todos los aspectos que las rodean: avances terapéuticos, calidad de vida, investigación básica y traslacional, aspectos sociales, laborales o médicos, etc. Podrán presentarse al galardón todos aquellos trabajos periodísticos publicados/emitidos en un medio de comunicación publicado en España entre el 1 de enero de 2018 y el 3 de febrero de 2019. Para más información sobre el premio y las bases visita: https://es.gsk.com/es-es/innovacion-responsable/somos-gsk-espana/innovamos-para-respirar-nace-el-premio-al-periodismo-en-respiratorio/
Fuente:

No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.